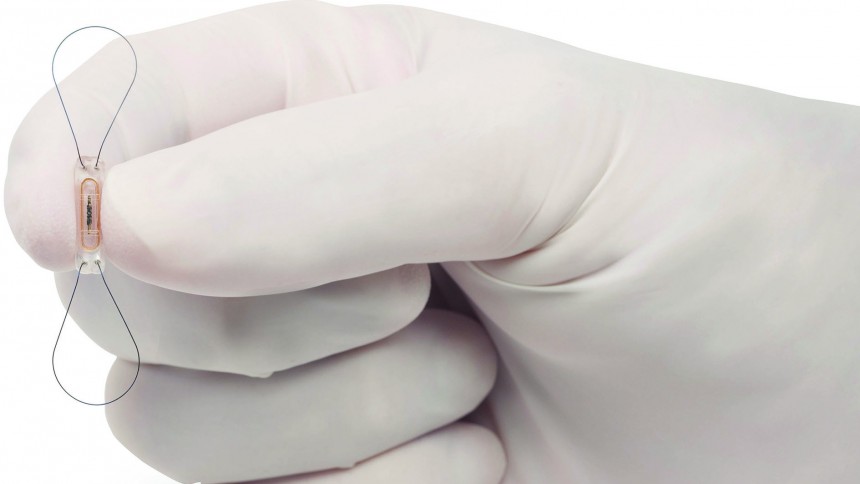
Mit Licht besser hören [1]
Die Verschmelzung von Biologie und Technik wird bei elektronischen Implantaten besonders deutlich. Sie helfen dabei, Körperfunktionen zu unterstützen, wie dies beim Herzschrittmacher seit Jahrzehnten erfolgreich praktiziert wird. Elektronische Implantate unterstützen die Sinnfunktionen der Menschen sollten sie gestört sein. Das Innenohr-Implantat ist ein bekanntes Beispiel hierfür. Retinachips sollen blinden Menschen das Sehen wieder ermöglichen. Nach Schätzungen der Weltgesundheitsorganisation WHO wird sich die Zahl der Menschen mit Hörverlust und Taubheit bis zum Jahr 2050 um 52 Prozent auf insgesamt 900 Millionen Menschen erhöhen. Bislang gibt es keinen ursächlichen Therapieansatz für das Innenohr.Menschen mit hochgradigem Hörverlust oder gar Taubheit kann aktuell mit elektrischen Cochlea-Implantaten (CI) geholfen werden. Das CI ist eine implantierbare Hörprothese, die Umgebungsgeräusche über einen externen Sprachprozessor aufnimmt, umwandelt und das Signal auf implantierte Elektroden in der Gehörschnecke überträgt. Dabei werden die defekten oder nicht vorhandenen Haarzellen umgangen und die Hörnervenzellen durch Stromimpulse direkt angeregt. Dieses Signal wird dann entlang der Hörbahn bis zur Hirnrinde weiterverarbeitet.Das Innenohr- oder Cochlea-Implantat (CI) ermöglicht über 700 000 hochgradig schwerhörigen und tauben Menschen weltweit wieder zu hören. Dabei wird der Hörnerv bisher durch elektrische Impulse stimuliert. Die Qualität dieses künstlichen Hörens unterscheidet sich stark von natürlichem Hören. Durch die ausgedehnte Stromausbreitung in der Gehörschnecke werden statt weniger Nervenzellen große Nervenzellgruppen aktiviert – vergleichbar mit dem Spielen eines Klaviers mit Boxhandschuhen statt mit einzelnen Fingern. Menschen mit CI können zwar in 1:1-Gesprächen kommunizieren, sind aber bei Umgebungsgeräuschen und mehreren Sprechern häufig auf Lippenlesen angewiesen. Auch der Musikgenuss ist stark eingeschränkt.Ein Problem beim Hören entsteht durch die elektrische Reizung in der mit Salzlösung gefüllten Cochlea: Trotz vieler Bemühungen lässt sich der Strom nicht ausreichend räumlich begrenzen. So werden viele Nervenzellen, die für ein breites Spektrum an Tonhöhen zuständig sind, gleichzeitig elektrisch angeregt. Die Zahl der unabhängigen Stimulationskanäle sind hier typischerweise auf unter zehn begrenzt. Eine grundlegende Verbesserung verspricht die zielgenaue Anregung des Hörnervs mit Licht. Die Anregung mit gerichtetem Licht verspricht, den Hörnerv gezielter zu reizen. Dafür müssen Viruspartikel in die Hörschnecke eingebracht werden, die einen molekularen Lichtschalter in die Hörnervenzellen einbauen. Dieser lässt sich mit Hilfe von schwachen Lichtpulsen aktivieren und imitiert so die Funktion der Haarzellen. Hören mit Licht könnte zukünftig CI-Nutzern eine feinere Unterscheidung von Tonhöhen, und somit ein besseres Verstehen von Sprache in lauter Umgebung sowie größeren Musikgenuss ermöglichen.Nach 12 Jahren Forschung zu grundlegenden Fragen zum Hören mit Licht ist die Hörforschung am Göttingen Campus um Prof. Dr. Tobias Moser, Direktor des Instituts für Auditorische Neurowissenschaften der Universitätsmedizin Göttingen (UMG), auf dem Weg zur Entwicklung eines optischen Cochlea-Implantats in Richtung klinische Anwendbarkeit. In Zusammenarbeit mit einem von Dr. Patrick Ruther geleiteten Team von Ingenieuren des Instituts für Mikrosystemtechnik (IMTEK) der Albert-Ludwigs-Universität Freiburg konnte ein für Langzeituntersuchungen geeignetes optisches Cochlea-Implantat System mit integrierten Mikro-Leuchtdioden (µLEDs) entwickelt werden. Im Tiermodell der menschlichen Schwerhörigkeit stimuliert dieses System den zuvor gentechnisch lichtempfindlich gemachten Hörnerv zielgenau mit optischen Pulsen. Das System ist viel kleiner und leichter als das klinisch genutzte CI und kann daher auch bei Nagetieren eingesetzt werden. Die Wissenschaftler sind noch einen wichtigen Schritt weiter gegangen und zeigen anhand von Verhaltensexperimenten, dass das optische CI tauben Nagetieren das Hören wieder ermöglicht – und das über Wochen [2].
700 000 Menschen hören mit dem CI wieder gut
In den Untersuchungen konnte erstmals die Funktionalität der neu entwickelten Cochlea-Implantate mit bis zu 10 µLEDs, die eine Kantenlänge von lediglich 0,25 Millimetern aufweisen, über einen Zeitraum von über einem Monat im Tiermodell getestet werden: Im Vorfeld der Experimente bekamen die Nager ein harmloses Virus injiziert, um ihren Hörnerv über molekulare Lichtschalter (Kanalrhodopsine) lichtempfindlich zu machen. Mit Hilfe von akustischen Reizen wurden die Tiere auf eine Verhaltensreaktion trainiert, danach medikamentös hörgeschädigt und mit einem optischen CI versorgt. Einige taube Tiere zeigten sofort das gleiche Verhalten auf das Lichtsignal wie zuvor bei normalem Hören im Training auf einen gespielten Ton. Dies könnte darauf hindeuten, dass die optische Stimulation dem natürlichen Höreindruck nahekommt.Um diesen Entwicklungsschritt zu erreichen, mussten die LED-Sonden gut verkapselt werden. Damit sollten die empfindlichen elektronischen Bauteile vor der in der Gehörschnecke befindlichen Salzlösung geschützt werden. Die Verkapselung der Implantate ist dabei entscheidend für deren Langzeitstabilität im Tiermodell. Ebenso wichtig für das Gelingen der Verhaltensexperimente über mehrere Wochen war die Entwicklung eines mobilen Prozessors am Institut für Auditorische Neurowissenschaften in Göttingen. Die kleine Recheneinheit wandelt Umgebungsgeräusche über ein integriertes Mikrofon in elektrische Signale um und überträgt diese an das optische CI. In der Miniaturisierung des optischen Cochlea-Implantats für die Testung an Nagetieren lag eine weitere Herausforderung für das interdisziplinäre Wissenschaftlerteam. Es sollte möglichst leicht sein, damit die Tiere es ohne Probleme im Verhaltensexperiment tragen können. Gerade mal 15 Gramm wiegt das gesamte CI-System. Diese Studie legt einen weiteren wichtigen Grundstein auf dem Weg zum Medizinprodukt in der klinischen Anwendung. Zukünftige Herausforderungen liegen in der Erhöhung der Kanalanzahl sowie der Weiterentwicklung zu noch besserer Langzeitstabilität und Sicherheit.
Ebenso wichtig für das Gelingen der Verhaltensexperimente über mehrere Wochen war die Entwicklung eines mobilen Prozessors am Institut für Auditorische Neurowissenschaften in Göttingen. Die kleine Recheneinheit wandelt Umgebungsgeräusche über ein integriertes Mikrofon in elektrische Signale um und überträgt diese an das optische CI. In der Miniaturisierung des optischen Cochlea-Implantats für die Testung an Nagetieren lag eine weitere Herausforderung für das interdisziplinäre Wissenschaftlerteam. Es sollte möglichst leicht sein, damit die Tiere es ohne Probleme im Verhaltensexperiment tragen können. Gerade mal 15 Gramm wiegt das gesamte CI-System. Diese Studie legt einen weiteren wichtigen Grundstein auf dem Weg zum Medizinprodukt in der klinischen Anwendung. Zukünftige Herausforderungen liegen in der Erhöhung der Kanalanzahl sowie der Weiterentwicklung zu noch besserer Langzeitstabilität und Sicherheit.
Herzinsuffizienz [3]
Fast vier Millionen Menschen leiden in Deutschland unter einer Herzinsuffizienz. Die Ursachen sind komplex. Die Lebenserwartung nimmt stetig zu und akute kardiovaskuläre Erkrankungen werden immer häufiger überlebt – nicht selten mit einer Herzinsuffizienz als Langzeitfolge. Hinzu kommen zahlreiche weitere Erkrankungen sowie gravierende Einschränkungen der Lebensqualität. Diese Volkskrankheit stellt sowohl für die Betroffenen als auch für das Gesundheitssystem eine enorme Belastung dar. Eine vielversprechende therapeutische Chance bietet die Früherkennung und präventive Behandlung von Verschlechterungen der Herzinsuffizienz. Klinische Symptome dieser sogenannten Dekompensation bemerken die Patienten in der Regel erst in einem fortgeschrittenen Stadium, wenn ein Krankenhausaufenthalt zur Behandlung dieses oft lebensgefährlichen Zustands nicht mehr zu vermeiden ist. Ein Druckanstieg in der Lungenarterie deutet indes meist schon Wochen zuvor die drohende Entgleisung an - früh genug, um durch eine geeignete vorbeugende Therapieanpassung einen weiteren Krankenhausaufenthalt zu verhindern.Das CardioMEMS™HF System bietet die Möglichkeit, mit einem in die Lungenarterie eingebrachten Sensor die Druckwerte täglich zu überwachen. Die Patienten leiten sie mit der elektronischen Patienteneinheit selbst ab und übertragen sie auf eine sichere Website, wo das Betreuungsteam sie überprüfen und je nach Ergebnis die Therapie flexibel anpassen kann. Professor Dr. Christiane Angermann vom Deutschen Zentrum für Herzinsuffizienz Würzburg (DZHI) berichtete beim Online-Kongress der Deutschen Gesellschaft für Kardiologie in einer „Late Breaking Clinical Trials“ Session am 23. Juni über die von ihr geleitete multizentrische MEMS-HF Studie, in der die Anwendung das CardioMEMS™HF Systems erstmals in drei europäischen Ländern untersucht wurde. Die Studienergebnisse wurden jetzt vom European Journal of Heart Failure veröffentlicht [4, 5]. Die MEMS-HF Studie bestätigt Ergebnisse der amerikanischen CHAMPION-Studie und zeigt, dass ein CardioMEMS-geführtes Herzinsuffizienzmanagement auch in Deutschland, den Niederlanden und in Irland machbar ist. 234 Patienten mit einer schweren Herzinsuffizienz (NYHA Klasse III – nach der vierstufigen Einordnung der New York Heart Association) erhielten in insgesamt 31 Zentren einen CardioMEMS Sensor. Komplikationen bei der Implantation oder ein Versagen des Sensors wurden nur in seltenen Ausnahmen beobachtet und waren nicht lebensbedrohlich, das System erwies sich also als sehr sicher. Die klinischen Erfolge waren deutlich: Die Hospitalisierungsrate war nach der Implantation des Sensors im Vergleich zum Jahr vorher um mehr als 60 Prozent reduziert, und die jährliche Sterblichkeit war mit weniger als 14 Prozent bei diesen Hochrisikopatienten relativ niedrig. Es wurde beobachtet, dass sich die Lebensqualität umso mehr verbesserte, je ausgeprägter die Drucksenkung in der Lungenarterie war. Die depressiven Symptome bildeten sich ebenfalls deutlich zurück. Dazu kamen eine während des gesamten Untersuchungszeitraums von zwölf Monaten anhaltende Verbesserung der Herzschwächesymptome bei über 40 Prozent der Patienten und ein hochsignifikanter Abfall des Herzschwächemarkers NT-proBNP. Die Biomarker BNP (brain natriuretic peptide) und NT-proBNP (N-terminales pro-BNP) sind Indikatoren für die Herzinsuffizienz und den Behandlungserfolg. Für die Studie wurden in den Zentren Pflegekräfte speziell geschult, die bei den Patienten auch das in Würzburg entwickelte Disease Management Programm HeartNetCare-HF™ anwendeten. Hier lernen Patienten Therapietreue und Selbstfürsorge und erhalten Informationen über das Krankheitsgeschehen. In MEMS-HF wurden besonders in der Anfangsphase die Medikamente oft angepasst, um den Lungenarteriendruck zu normalisieren. Wie weit das Disease Management zusätzliche positive Effekte hatte, ließ sich in der Registerstudie nicht sicher unterscheiden. Wahrscheinlich haben Patientenschulung und -information zu den guten Studienergebnissen mit beigetragen. Das CardioMEMS™HF System nur ein Hilfsmittel, es stellt nicht selbst eine Therapie dar. Sein Nutzen hängt daher immer ganz entscheidend von der nachgeschalteten Effektorseite ab, also davon, wie gut das Betreuungsteam das System zur Optimierung der Behandlung nutzt, und wie zeitnah und umfassend gut informierte Patienten die Behandlungsempfehlungen umsetzen.
Mit Elektrostimulationen besser sehen [6]
Im Rahmen von Horizon 2020 untersuchen Forschende aus sieben europäischen Institutionen, wie sich das Sehvermögen von Blinden durch elektrische Gehirnstimulationen aktivieren lässt. Das internationale Projekt „Neural Active Visual Prosthetics for Restoring Function“, das einen EU-Forschungsrahmenkredit über 4 Millionen Euro für vier Jahre erhält wird von Prof. Shih-Chii Liu vom Institut für Neuroinformatik der Universität Zürich koordiniert und startete am 1. September 2020.Das Team von Forschenden möchte zusammen mit Spezialistinnen und Spezialisten für Computer-, System- und klinische Neurowissenschaften, Werkstofftechnik, Mikrosystemdesign und Deep Learning aus sieben europäischen Universitäten und Institutionen neue Technologien entwickeln, um die visuelle Wahrnehmung von Blinden mithilfe von elektrischen Gehirnstimulationen zu verbessern. Ziel ist es, eine Neuroprothese für Blinde mit Tausenden von Elektroden zu konstruieren. Dazu werden adaptive maschinelle Lernalgorithmen für die Stimulation mit einer Gehirn-Computer-Schnittstellentechnologie entwickelt. Diese neuartige Hirn-Neuroprothese soll leicht, robust und gut tragbar sein und über Jahrzehnte hinweg effizient arbeiten. Bisherige Systeme stimulieren nur wenige Neuronen im Gehirn und sind nur einige Monate aktiv gewesen.Im Projekt sollen neue Ansätze für die Stimulation der Gehirnzellen im visuellen Kortex und eine Schnittstelle mit hoher Elektrodenanzahl entwickelt werden. Dazu braucht es dünne, flexible Sonden sowie neue, stabile Elektrodenbeschichtungen und neuartige Mikrochip-Methoden. Zudem müssen die Stimulationsströme an tausenden Elektroden kanalisiert und die neuronale Aktivität in den verschiedenen Gehirnschichten beobachtet werden.Innovationen sind ebenfalls zu erwarten bei künstlichen neuronalen Netzwerken, die durch mehrschichtiges Lernen (Deep Learning) trainiert werden: Die Netzwerke sollen nur die wichtigen visuellen Informationen extrahieren, die durch die Kamera generiert werden. So können die Blinden Objekte und Gesichtsausdrücke besser erkennen und sich auch im ungewohnten Umfeld zurechtfinden. Dabei müssen die Aufnahmen der Prothesenkamera in Stimulationsmuster umgewandelt werden, welche die Neuronen so stimulieren, dass sie für die Testpersonen verständlich sind. Nur so können Neuronen die Signale verarbeiten und weitergeben. Gleichzeitig soll durch Eyetracking rückgemeldet werden, welche Bilder noch nicht exakt genug umgewandelt wurden.Die Universität Zürich trägt neben der Koordination auch ihr technisches Know-how bei: Das Neuroinformatik-Team um Shih-Chii Liu und Tobi Delbruck entwickelt zusammen mit Partnern aus dem Konsortium eine neuromorphe Hardware und die passenden Algorithmen. Das in der Hardware integrierte Netzwerk übersetzt den Input der Kamera in Stimulationsmuster zur Erregung der Elektroden.Dieses Forschungsprojekt soll bahnbrechende Arbeiten für die Konstruktion einer neuen Hirn-Neuroprothese leisten und auch andere Neuroprothesenforschung beeinflussen.
Literatur
[1] Quelle: Universitätsmedizin Göttingen / mbexc
[2] D. Keppeler*, M. Schwaerzle*, T. Harczos*, L. Jablonski, A. Dieter, B. Wolf, et al.: Multichannel optogenetic stimulation of the auditory pathway using microfabricated LED cochlear implants in rodents. Science Translational Medicine, 22.07.2020, doi: 10.1126/scitranslmed.abb8086; * equal contribution
[3] Quelle: DZHI Uni Würzburg
[4] https://pubmed.ncbi.nlm.nih.gov/32592227/Angermann CE, Assmus B, Anker SD, et al.: Pulmonary artery pressure-guided therapy in ambulatory patients with symptomatic heart failure: the CardioMEMS European Monitoring Study for Heart Failure (MEMS-HF) [published online ahead of print, 2020 Jun 27]. Eur J Heart Fail. 2020;10.1002/ejhf.1943. doi:10.1002/ejhf.1943
[5] Angermann CE, Assmus B, Anker SD, Brachmann J, Ertl G, Köhler F, Rosenkranz S, Tschöpe C, Adamson PB, Böhm M.: Safety and feasibility of pulmonary artery pressure-guided heart failure therapy: rationale and design of the prospective CardioMEMS Monitoring Study for Heart Failure (MEMS-HF). Clin Res Cardiol. 2018 Nov;107(11):991-1002. doi: 10.1007/s00392-018-1281-8. Epub 2018 May 19.
[6] Quelle UZH