Zu häufig wird die Geschichte von Technologien im Spannungsfeld von Empirik und Wissenschaft einseitig und verzerrt wiedergegeben. In der Galvanotechnik gibt es hierzu jedoch keinerlei Veranlassung. Um einen Sachverhalt, sei er eher praktischer oder theoretischer Natur, möglichst vollumfänglich nachzuvollziehen oder gar zu verstehen, muss man sich diesen aus möglichst vielen, idealer- weise allen zugänglichen Betrachtungswinkeln und aus allen Richtungen kommend ansehen. Dabei ist es besonders interessant, wie unterschiedlich sich diverse naturwissenschaftliche und technische Disziplinen ein und demselben Sachverhalt nähern. Von innen, also alleine aus der jeweiligen Disziplin heraus, erscheint das Bild dabei häufig und fälschlicherweise komplett, während andere Zugänge die jeweiligen erkenntnistheoretischen Fehlstellen wechselseitig eher, wenn auch niemals vollständig, offenbaren.
In diesem Beitrag möchte ich einer mir aufgefallenen Parallele näher auf den Grund gehen, nämlich zwischen der galvanischen Abscheidung und dem chemischen Transport, was mich zu dem Schluss bringt, die galvanische Abscheidung als elektrochemischen Transport bezeichnen bzw. beschreiben zu wollen.
Zunächst soll näher auf den von dem berühmten deutschen Chemiker Harald Schäfer geprägten Begriff des chemischen Transports eingegangen werden [1, 2]. Wie die Bezeichnung dieser Technik nahelegt, ist es dadurch möglich, Feststoffe von einem Ort zu einem anderen zu transportieren. Dies geschieht dadurch, dass man sich ein chemisches Gleichgewicht zu Nutze macht, welches auf einer Seite den zu transportierenden Feststoff sowie weitere gasförmige Reaktanten aufweist, während auf der anderen Seite ausschließlich gasförmige Reaktanten vorliegen. Da als Steuergröße die Temperatur genutzt wird, muss die Gleichgewichtslage temperaturabhängig, d.h. ΔH ≠ 0, sein. Letzteres ist bis auf wenige Ausnahmen ohnehin die Regel, so dass es primär darauf ankommt, dass die zuvor erwähnten Bedingungen an die Aggregatzustände erfüllt sind. Desweiteren ist für manche Anwendungen die Transportrichtung von Bedeutung, das heißt, ob von „kalt nach heiß“ oder „heiß nach kalt“ transportiert werden soll. Nach Schäfer lässt sich der chemische Transport in 3 Schritte einteilen [1]:
- 1) Gleichgewichtseinstellung bei T1
- 2) Transport des Gleichgewichtsgases
- 3) Gleichgewichtseinstellung bei T2
Gleichung <1> zeigt die allgemeine Formulierung eines für den chemischen Transport geeigneten Gleichgewichts.
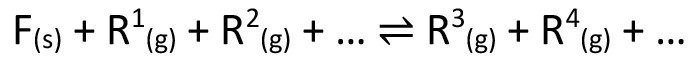
<1>
F = transportierter Feststoff
R = gasförmige Reaktanten
Dabei lässt sich die Transportrichtung nach dem Prinzip von Le Chatelier aus dem Vorzeichen der Reaktionsenthalpie herauslesen. Im Folgenden legen wir das vereinfachte Gleichgewicht gemäß Gleichung <2> zu Grunde:
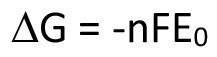
<2>
Bei ΔH > 0 findet ein Transport von heiß nach kalt und bei ΔH < 0 ein Transport von kalt nach heiß statt. Abbildung 1 zeigt schematisch den Ablauf eines chemischen Transports.
 Abb. 1: Schematische Darstellung der temperaturabhängigen Gleichgewichtslage beim chemischen Transport
Abb. 1: Schematische Darstellung der temperaturabhängigen Gleichgewichtslage beim chemischen Transport
Die Transportgeschwindigkeit, welche proportional zur Differenz der Partialdrücke von R1 bzw. R2 in den Temperaturzonen T1 bzw. T2 ist, hängt jedoch vom genauen Betrag von ΔH sowie vom Betrag und dem Vorzeichen von ΔS ab [3]. Dabei gilt, dass bei ΔH = 0 kein sowie bei betragsmäßig sehr hohen ΔH praktisch kein Transport stattfindet. Im Falle eines Gleichgewichts wie in Gleichung <2>, in dem sich die Molzahl der Gasteilchen nicht ändert, ist ΔS naturgemäß sehr klein. Für Fälle mit betragsmäßig größeren ΔS muss auch ΔH das gleiche Vorzeichen haben. Dies ist dadurch begründet, dass ein Transport durch extreme Gleichgewichtslagen, also bei betragsmäßig hohen ΔG, unterdrückt wird. K darf sich also nicht zu sehr von 1 unterscheiden.
Die Temperaturabhängigkeit chemischer Reaktionen ergibt sich gemäß Gleichung <3> aus dem Zusammengang zwischen der Gibbsschen freien Enthalpie ΔG und der Gleichgewichtskonstanten K.
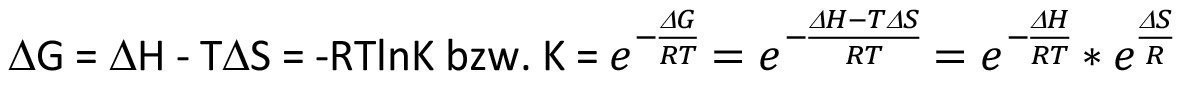
<3>
Wie allgemein bekannt, liegt das Gleichgewicht 2 bei positivem ΔG auf Seiten der Edukte und bei negativem ΔG entsprechend auf Seiten der Produkte. Unter diesen Gegebenheiten bleibt jedoch immer noch die absolute Temperatur T als Parameter, welcher Einfluss auf die Gleichgewichtslage nimmt. Bei positivem ΔG bzw. ΔH führt eine Temperaturerhöhung zu einem größeren K, d.h. das Gleichgewicht liegt dann weniger stark auf Seiten der Edukte. Bei negativem ΔG bzw. ΔH hingegen führt eine Temperaturerhöhung zu einem kleineren K, d.h. das Gleichgewicht liegt dann weniger stark auf Seiten der Produkte.
Im Labormaßstab benötigt man, um einen chemischen Transport durchzuführen, einen 2-Zonen-Tempe- raturofen. Den zu transportierenden Feststoff schmilzt man in eine Glasampulle ein, deren Enden sich jeweils in der einen bzw. anderen Temperaturzone befinden. Idealerweise benötigt man nur einen eduktseitigen und einen produktseitigen gasförmigen Reaktanten. Am einfachsten wird dieser (der eduktseitige) ebenfalls im festen Aggregatzustand zusammen mit dem zu transportierenden Feststoff in die Ampulle eingeschmolzen, der produktseitig gasförmige Reaktant bildet sich dann automatisch im Zuge der Gleichgewichtseinstellung. Dazu kühlt man das untere Ende auf die entsprechend benötigte Temperatur ab und füllt bzw. kondensiert den festen Reaktanten ein. Besonders eignet sich vor diesem Hintergrund Iod, falls ein entsprechend nutzbares Gleichgewicht existiert. Bei positivem ΔH positioniert man das Ende der Glasampulle mit den Edukten im Bereich mit höherer Temperatur T2, bei negativem ΔH entsprechend im Bereich mit niedrigerer Temperatur T1.
Zum einen bildet sich durch den abgeschlossenen Reaktionsraum in der gesamten Ampulle ein gleicher Gesamtdruck aus. Zum anderen führen die unterschiedlichen Temperaturen und der sich dadurch ausbildende Temperaturgradient zu einer ortsabhängigen Gleichgewichtslage mit den jeweiligen Extremen in den Bereichen der Maximal- bzw. Minimaltemperatur, also an den Ampullenenden. Dadurch unterscheiden sich bei gleichem Gesamtdruck die Partialdrücke der jeweiligen Reaktanten am Ort der Auflösung bzw. der Wiederabscheidung, wobei der dadurch hervorgerufene Konzentrationsgradient Diffusionsvorgänge auslöst. Dies führt zu dem entsprechenden Netto-Stofftransport. Darüber hinaus kommt es auch zu Rekristallisationsvorgängen.
Hier besteht eine Analogie zur Rekristallisation von Kristalliten im Kontakt zur Mutterlauge, ein Beispiel für die Ostwald-Reifung. Diese besagt allgemein, dass bei der chemischen oder physikalischen Neubildung einer Phase zunächst und dadurch auch nur zwischenzeitlich diejenigen Spezies gebildet werden, welche aufgrund der Kinetik der zugrundeliegenden Vorgänge bevorzugt werden. Auf lange Sicht hingegen setzt sich die Thermodynamik durch, was zum Beispiel dazu führt, dass es nach einem Auskristallisieren im Kontakt zur Mutterlauge zu Rekristallisationsvorgängen kommt, bei denen die größeren Kristallite auf Kosten der kleineren weiterwachsen, während sich Letztere auflösen. Dies liegt daran, dass die Mutterlauge aus Sicht der kleineren Kristallite unter-, jedoch aus Sicht der größeren Kristallite übersättigt ist. Theoretisch sollte dies dazu führen, dass am Ende nur ein großer Kristall(it) verbleibt. Jedoch ist dies meist nicht der Fall, da der Anteil der Oberflächenenergie der Kristallite, dessen Reduktion die Triebkraft der Ostwald-Reifung darstellt, nur bei vergleichsweise kleinen Keimen und Kristalliten einen signifikanten Beitrag zur Gesamtenergie der Keime liefert.
Beim chemischen Transport spielt der Unterschied der Kristallitgrößen aus dem gleichen Grund zwar ebenfalls eine Rolle, allerdings ist die treibende Kraft hier die Tat- sache, dass die zugrundeliegende Reaktion an allen Stellen im bestehenden Temperaturgradienten aus dem Gleichgewicht ausgelenkt ist. Auf der Ausgangsseite der Edukte ist das Gleichgewicht produktseitig verschoben, so dass hier netto eine Produktbildung stattfindet, während auf der Transportzielseite das Gleichgewicht eduktseitig verschoben ist, so dass sich hier netto wiederum die Edukte bilden.
Großtechnisch wird der chemische Transport vor allen Dingen zur Reinigung von Metallen verwendet. Bekannte Beispiele sind der van-Arkel-de-Boer-Prozess, welcher zur Aufreinigung von Titan zum Einsatz kommt (Gl. <4>), ebenso wie der Mond-Prozess zur Aufreinigung von Nickel (Gl. <5>).
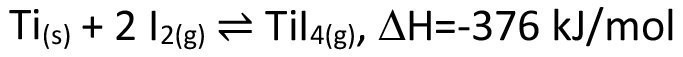
<4>
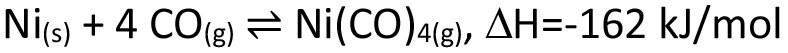
<5>
Am häufigsten begegnet uns jedoch das Prinzip des Chemischen Transports im Alltag beim Gebrauch von Halogenlampen. Diese beruhen auf dem klassischen Prinzip des schwarzen Strahlers, bei dem ein erhitzter Festkörper in Abhängigkeit seiner Temperatur ein Spektrum elektromagnetischer Wellen abstrahlt. Um eine möglichst hohe Ausbeute im Bereich des sichtbaren Lichts zu erzielen, sind hier sehr hohe Temperaturen notwendig, bei denen der zum Einsatz kommende Wolframfaden bereits zur Verdampfung neigt. Bilden sich im Zuge dieser Verdampfung nun Stellen mit geringfügig verringertem Fadendurchmesser aus, führt der damit einhergehende, erhöhte Ohmsche Widerstand zu einem weiteren lokalen Temperaturanstieg, sodass ein Durchbrennen des Fadens an eben dieser Stelle vorprogrammiert ist. Durch Zugabe geringster Mengen eines Halogens wie Chlor oder Iod zum eigentlichen Lampengas Krypton (welches wegen seiner schlechten Wärmeleitfähigkeit und damit guten Isolierwirkung verwendet wird), wird dem Verdampfungsprozess (Transport vom heißen Wolframfaden zur vergleichsweise kühlen Lampenglasinnenwand) ein weiterer, exakt entgegengesetzter chemischer Transportprozess überlagert (Gl. <6>), der Wolfram von der kühlen Lampenwand zurück an die heißeste und damit dünnste Stelle des Wolframglühwendels bringt. Dadurch lassen sich Temperaturen von bis zu 3200 °C erzielen, was nur rund 200 °C unterhalb des Schmelzpunktes von Wolfram liegt. Ein ausgesprochen schlauer Ansatz, 1959 von der Firma GE zum Patent angemeldet [4]. Möglicherweise ist diese Idee aber auch dadurch entstanden, dass man zuvor in Atmosphären mit Spuren von Wasser den umgekehrten Fall mit einer verstärkten Abtragung des Wolframs bzw. Molybdäns an dünnen Stellen eines Glühwendels beobachtet hatte, zurückzuführen auf Gleichung <7> [5]. Die Kenntnis, dass z.B. Spuren von Iod die Lebensdauer entsprechender Vorläuferlampen deutlich verlängern kann, war jedoch bereits seit 1918 bekannt [6].
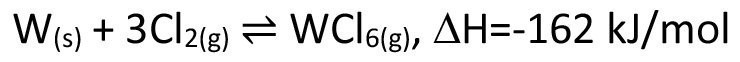
<6>
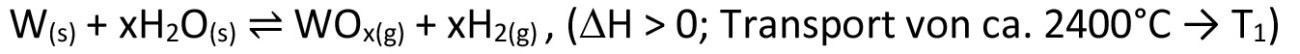
<7>
Der gesamtwirtschaftlich wahrscheinlich wichtigste Prozess ist jedoch der Hochofenprozess zur Eisen- bzw. Stahlherstellung. Hierbei dienen Eisenerz und Koks als Edukte. Der Kohlenstoff reduziert das Eisenerz jedoch nicht direkt, sondern es bildet sich über das Boudouard-Gleichgewicht (Gl. <8>) Kohlenmonoxid, welches als gasförmiges Reduktionsmittel das Eisenerz viel schneller und vollständiger reduzieren kann, also es in einer reinen Festkörperreaktion der Fall wäre.
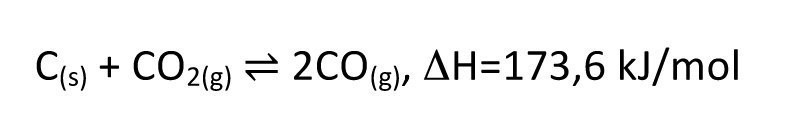
<8>
Übrigens wird die Vorteilhaftigkeit gasförmiger Reaktanten in der Oberflächentechnik auch bei der Erzeugung thermochemischer Schichten genutzt. Hierbei bietet man das Fremdelement ebenfalls „atomweise“ über Gasphasengleichgewichte an, die man auch für den chemischen Transport nutzen könnte. Triebkraft ist dabei jedoch nicht ein Temperaturgradient, sondern ein Konzentrationsgradient des Fremdelements im Substrat.
Diese Zusammenhänge spiegeln sich im bereits erwähnten Prinzip von Le Chatelier wider, auch Prinzip des kleinsten Zwangs genannt. Demnach weicht ein System einem von außen auferlegten Zwang dadurch aus, dass es zu einer Verschiebung im System kommt, welche den äußeren Zwang reduziert. Da es sich in der für den chemischen Transport verwendeten Ampulle um ein und dasselbe System handelt, welches jedoch einem Zwangstemperaturgradienten ausgesetzt ist, wird die Verschiebung durch einen Nettofeststofftransport sichtbar.
An dieser Stelle wird nun die anfangs erwähnte Ähnlichkeit zur galvanischen Abscheidung sichtbar. Auch hier ist es so, dass wir, betrachtet man zunächst nur das zu beschichtende Substrat, durch Verschiebung des inneren Potentials, d.h. des Galvani-Potentials des i.d.R. metallischen Substrats, das elektrochemische Potential der Metallatomrümpfe Mez+, welche den Ionen auf der Elektrolytseite entsprechen, verändern, siehe Gleichung <9>.

<9>
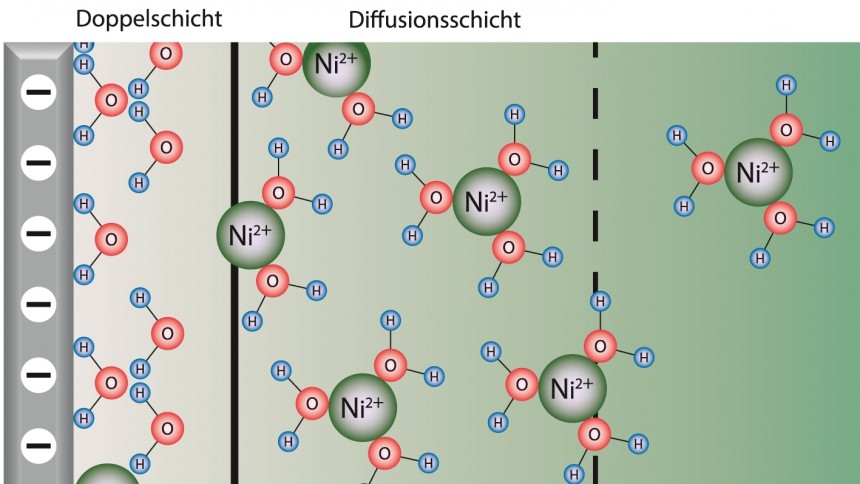
Hinsichtlich dieser Metallatomrümpfe respektive Metallionen ist die Substrat/Elektrolyt-Phasengrenze bei einer solchen sogenannten Metall/Metallionen-Elektrode nämlich semipermeabel, d. h. durchlässig, während die Phasengrenze für die weitere „Komponente“ des Metalls, den Elektronen, im Hinblick auf die Metall-/Metallionen-Elektrode, praktisch nicht permeabel ist, was Abbildung 2 schematisch zeigt.
Die mikroskopischen Vorgänge bei der Durchtrittsreaktion seien hier bewusst außen vor gelassen, ebenso die Tatsache, dass eine Elektrode sehr wohl Elektronen in den Elektrolyt abgeben kann, z.B. auf ein Redoxpaar wie Fe2+/Fe3+ oder an das Lösungsmittel, was bei Wasser zur bekannten Wasserstoffentwicklung als Nebenreaktion führt.
Der wichtige Zusammenhang zwischen der klassischen und der Elektrochemie wird deutlich, wenn man die jeweils maximal zur Verfügung stehende Arbeit, welche in der Gibbsschen freien Enthalpie zum Ausdruck kommt, betrachtet. Gleichung <10> zeigt den entsprechenden Zusammenhang mit dem Gleichgewichtspotential (offenen Zellpotential).
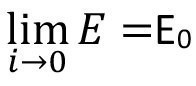
<10>
Dies kann so verstanden werden, dass die verrichtete elektrische Arbeit bei Annäherung der Stromdichte gegen Null einem Grenzwert, nämlich der Gibbsschen freien Enthalpie, zuläuft, welche die maximal verrichtbare Arbeit darstellt. Im selben Zuge gehen die Überspannungen und auch der IR-Abfall (über dem Elektrolyt abfallende Spannung) gegen Null. Dies kommt in Gleichung <11> zum Ausdruck.
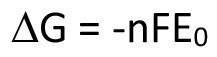
<11>
Das auf den ersten Blick Außergewöhnliche an der Elektrochemie ist eben diese Möglichkeit, elektrochemische Gleichgewichtslagen, genauer gesagt Halbzelllagen, definiert durch eine von außen leicht beherrschbare Größe wie das Elektrodenpotential, einstellen zu können (mit E = Differenz der Elektrodenpotentiale). Auf diese Weise können thermodynamisch exakte Bedingungen vorgegeben werden, die es beispielsweise erlauben, elektrochemische Reaktionen mit hoher Selektivität durchzuführen. Meist bleibt der Fokus auf einer der beiden Elektroden, je nachdem, ob die Produkte mittels Reduktion oder Oxidation aus den Edukten hervorgehen. Will man im Interesse der Effizienzsteigerung sowohl die reduktive als auch oxidative Teilreaktion gewinnbringend nutzen, bezeichnet man dies als sogenannte 200 %-Reaktionen. In der klassischen Chemie spricht man in diesem Zusammenhang von Nebenprodukten, im Unterschied zu Abfallprodukten. Ein Beispiel für einen industriell etablierten 200 %-Prozess ist die Chloralkalielektrolyse, bei der als Nebenprodukt der Chlorherstellung Wasserstoff und zusätzlich Natronlauge gewonnen werden (eigentlich sogar ein 300 %-Prozess, da jedes umgesetzte Elektron dreifach „verwertet“ wird). Der Vorteil zu klassischen Reaktionen liegt hier eben auch in der naturgemäßen örtlichen Trennung der Reaktionsräume. Im Falle der Chlorherstellung ist dies sogar ausgesprochen wichtig, um eine Disproportionierung des Chlors im Alkalischen zu verhindern.
In der Galvanotechnik ist der Fokus normalerweise auf die Kathode gerichtet, wenn auch jedem Fachmann klar ist, dass die Anodenreaktion im Interesse von stabilen Prozessbedingungen ebenso viel Aufmerksamkeit verdient. In der Praxis arbeitet man hier, im Unterschied zum Beispiel zur Elektrosynthese, galvanostatisch. Dies hat vor allem praktische Gründe, lassen sich so doch konstante Abscheideraten erzielen, was das Erreichen von Zielspezifikationen und das Zeitmanagement bei der Beschichtung vereinfacht. Im Unterschied zur klassischen Elektrochemie haben wir es außerdem, zumindest in der Galvanostegie, mit einem Fall zu tun, bei dem das gewünschte elektrochemische Reaktionsprodukt auf dem eigentlich als Hilfsmittel dienenden Substrat, der Elektrode, verbleibt. Selbst bei der Galvanoformung, bei der die abgeschiedene Schicht in einem zweiten Schritt wieder vom Substrat getrennt wird, ist das Vorhandensein eben dieses Substrats wenigstens intermediär zwingend erforderlich.
Im Folgenden sollen nun die Parallelen und auch Unterschiede zwischen dem chemischen Transport und der galvanischen Abscheidung (elektrochemischer Transport) aufgezeigt werden:
Aus thermodynamischer Sicht wird bei der galvanischen Abscheidung durch ausreichende Absenkung des Kathodenpotentials bzw. Anhebung des Anodenpotentials jeweils ein Potentialgefälle zwischen den Elektroden und dem Elektrolyten erzeugt, welches das Gesamtsystem dazu veranlasst, Ausgleichsreaktionen ablaufen zu lassen, die „das Ziel“ haben, das Gesamtsystem wieder ins Gleichgewicht zu bringen. Selbstverständlich hat der Fachmann kein Interesse an einem solchen Ausgleich, ganz im Gegenteil soll die kathodische Abscheidung unter Konstanthaltung der Abscheideparameter unverändert weiterlaufen. Dies wird dadurch sichergestellt, dass sich durch geeignete Maßnahmen die Konzentrationsverhältnisse der Ionen des abzuscheidenden Metalls im Elektrolytinneren im Mittel nicht ändern. Im Falle einer löslichen Anode wird man daher eine gleiche kathodische wie anodische Effizienz anstreben, im Falle einer unlöslichen Anode wird man kontinuierlich nachergänzen. Durch die in der Regel hohe Leitfähigkeit des Elektrolyten ist der Potentialgradient im Bereich der Elektrode/Elektrolyt-Phasengrenzen sehr hoch, während er im Elektrolyten vergleichsweise gering ist, da dort nur der ohmsche Elektrolytwiderstand überwunden werden muss. Die Potentialgradienten an den Phasengrenzen sind hingegen die Triebkraft der elektrochemischen Vorgänge (Durchtrittsreaktionen, vgl. Durchtrittsüberspannung) und dienen außerdem der Kompensation von Konzentrationsverschiebungen in den Elektrolytfilmen (Diffusions- und Reaktionsüberspannung) sowie den Elektrodenoberflächen (Kristallisationsüberspannung) und damit verbundenen Änderungen im ohmschen Widerstand (Widerstandsüberspannung). Aus Sicht der Kathode ist das oben beschriebene Ziel, vor dem Hintergrund eines angestrebten Ausgleichs und damit einer Wiederherstellung von Gleichgewichtszuständen, die Konzentrationen der metallischen Spezies im Elektrolyt soweit zu verringern, dass die kathodische und anodische Teilreaktion an der Kathode wieder gleich schnell ablaufen. Analog „verfolgt“ die Anode das Ziel, die Konzentrationen der metallischen Spezies im Elektrolyt soweit zu erhöhen, dass die kathodische und anodische Teilreaktion an der Anode wieder gleich schnell ablaufen. Hier besteht nun die erste Analogie zum chemischen Transport, bei dem ein und dieselbe zugrundeliegende chemische Reaktion durch einen räumlichen Temperaturgradienten einen örtlich variablen Gleichgewichtszustand anstrebt. Bei der galvanischen Abscheidung unter Verwendung löslicher Anoden sind es bei planparalleler Ausrichtung beider Elektroden zwei definierte Orte bzw. Ebenen (senkrecht zu den Elektrodenoberflächen betrachtet), an bzw. in denen eine dem jeweiligen Elektrodenpotential entsprechende Gleichgewichtslage durch einen Nettoübergang von Metallionen in den Elektrolyten (Anode) bzw. auf die Elektrode (Kathode) angestrebt wird. Nun könnte man leicht an die Hullzellen-Geometrie denken, um eine Analogie zur räumlichen Abhängigkeit des chemischen Transports zu finden. Diese Analogie ist jedoch nur teilweise gegeben. Tatsächlich kommt es auf der Arbeitselektrode, verursacht durch einen variablen Abstand zur Gegenelektrode und damit einen ortsabhängigen ohmschen Elektrolytwiderstand zu einem logarithmischen Verlauf der primären Stromdichte. Im Gegensatz zum chemischen Transport, bei dem die örtlich unterschiedlichen Gleichgewichtslagen dazu führen, dass der zu transportierende Feststoff in die jeweiligen Extremregionen (hier bezogen auf die Temperatur) transportiert wird, tritt bei Elektroden, die ja entweder als Ganzes kathodisch oder anodisch polarisiert (bzw. im Gleichgewicht) sind, keine sukzessive Verlagerung des kathodisch abgeschiedenen Metalls in die Bereiche mit höchster Feldstärke bzw. primärer Stromdichte auf. Durch die vielfältigen Möglichkeiten, über die Elektrolytzusammensetzung auf die Streufähigkeit einzuwirken, lassen sich bekanntermaßen selbst Inhomogenitäten im elektrischen Feld geschuldete potentielle Ungleichmäßigkeiten in der Schichtdicke verhindern bzw. abmildern. Die galvanische Abscheidung profitiert dabei also von der Tatsache, dass in flüssigen Elektrolyten die Wechselwirkungen zwischen den Bestandteilen deutlich stärker als in einem Gas sind, was sich für den jeweils verfolgten Zweck gewinnbringend nutzen lässt. Eine Ähnlichkeit zum chemischen Transport hingegen kann man erkennen, wenn mit Mittelleitern gearbeitet wird. Diese befinden sich im zwischen den eigentlichen Elektroden befindlichen elektrischen Feld und sind daher auch an ihren Enden entgegengesetzt, also anodisch bzw. kathodisch, polarisiert. Dieser Effekt kann daher zu einer simultanen ortsabhängigen Materialabtragung bzw. -abscheidung auf dem Mittelleiter führen.
Wir dürfen an dieser Stelle nicht vergessen, dass sich die bisherigen Überlegungen beim chemischen Transport nur auf die thermodynamische Gleichgewichtslage bezogen haben, wenn auch schon bemerkt wurde, dass der Transport in der Regel diffusionskontrolliert stattfindet. Für die galvanische Abscheidung wurde bereits gemäß der üblichen Betrachtungsweise über die Abscheidungskinetik (Ionentransport im Elektrolyt und auf den Elektrodenoberflächen, vor- und nachgelagerte Reaktionen, Durchtrittsreaktion) argumentiert. Darf man also an dieser Stelle in einer Analogie zum chemischen Transport von unterschiedlich ausgelenkten Gleichgewichten sprechen?
Ein wesentlicher Unterschied liegt natürlich darin, dass man durch die für die Elektrochemie typische räumliche Trennung von Oxidation- und Reduktion lokal immer nur Halbzellen betrachtet, während es beim chemischen Transport „vollwertige“ Reaktionsgleichungen sind. Betrachtet man bei der galvanischen Abscheidung mit löslicher Anode die Gesamtreaktion, ist diese relativ ernüchternd, da es sich gemäß Gleichung <12> eigentlich um gar keine chemische Reaktion im engeren Sinne zu handeln scheint.
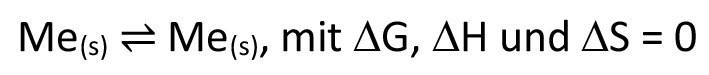
<12>
Es wird also in diesem Beispiel chemisch betrachtet gar nichts umgewandelt, sondern durch die räumliche Trennung von Anode und Kathode lediglich transportiert. Da alle Atome eines isotopenreinen Elements absolut identisch sind bzw. wir immer von der gleichen Isotopenverteilung ausgehen, kann man also tatsächlich von einem Transport sprechen, wenn auch der Großteil des abgeschiedenen Metalls seinen Ursprung nicht an der Anode sondern im Elektrolyten hat. Auch kann sich natürlich der Aufbau des abgeschiedenen Metalls in seiner Kristallitgröße und weiteren, durch Nebenreaktionen co-abgeschiedenen Stoffen unterscheiden, was maßgeblich von den gewählten Parametern abhängt und in der Praxis der Galvanotechnik eine sehr wichtige Rolle spielt. Dass der Transport darüber hinaus, obwohl keinerlei Energie chemisch gespeichert wird, trotzdem etwas „kostet“, sehen wir daran, dass wir, je nach Geschwindigkeit, eine gewisse Spannung anlegen müssen, die dann, multipliziert mit der geflossenen Gesamtladungsmenge (dem Integral des Zellstroms), den erforderlichen Energieaufwand widerspiegelt. Nach dem ersten Hauptsatz der Thermodynamik ist diese Energie jedoch nicht vernichtet, sondern hat lediglich ihre Form geändert und als Wärmeenergie dazu beigetragen, das System bzw. die Umgebung aufzuheizen. Dass wir hier tatsächlich von einem (elektro)chemischen Prozess sprechen dürfen, zeigt sich auch daran, dass wir bei ausschließlicher Nutzung physikalischer Prozesse, beispielsweise über Wechsel im Aggregatzustand (Transport über den flüssigen oder gasförmigen Zustand), unter drastischeren Bedingungen arbeiten müssten. Die Elektrochemie ist hier also in den beiden kombinierten Halbzellen begründet, die in unserem Beispiel eben identisch sind, so wie beim chemischen Transport immer die gleiche Reaktion zu Grunde liegt. Beide Halbzellen sind, muss doch in der einen die Oxidation und der anderen die Reduktion ablaufen, entgegengesetzt ausgelenkt. Dieser Aufwand hebt sich dabei in Summe nicht etwa auf, sondern addiert sich, vgl. Gleichung <13>.
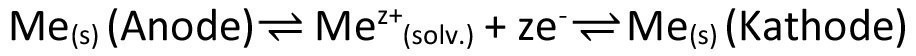
<13>
Dabei befinden sich die Elektronen nicht mit den Metallkationen im Elektrolyten, sondern „wandern“ im äußeren Stromkreis. Den schematischen Ablauf zeigt Abbildung 2.
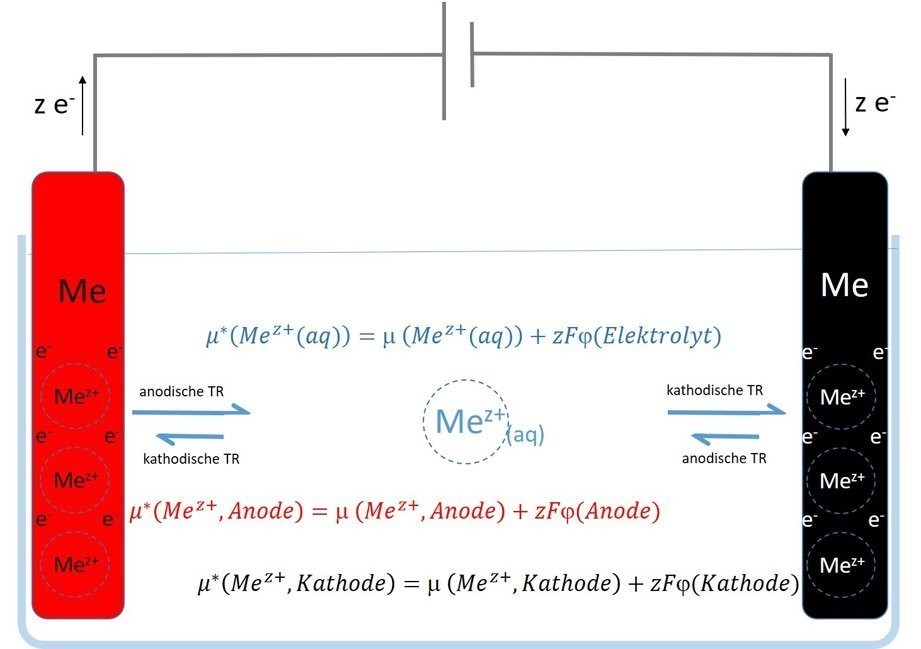 Abb. 2: Schematischer Aufbau der galvanischen Abscheidung mit löslicher Anode und auftretende Halbzellgleichgewichte
Abb. 2: Schematischer Aufbau der galvanischen Abscheidung mit löslicher Anode und auftretende Halbzellgleichgewichte
Vergleicht man die beiden Prozesse des chemischen und elektrochemischen Transports, treten in beiden Fällen am Ausgangs- und Endpunkt heterogene Reaktionen auf, dazwischen erfolgt ein Transportprozess im Gas bzw. im Elektrolyten, respektive im äußeren Stromkreis. Grundsätzlich ist in beiden Fällen die absolute Menge an transportiertem Stoff proportional zur angebotenen Fläche (wenn es sich im Falle des chemischen Transports zum Beispiel um ein entsprechend erhitztes Filament handelt), solange keine Limitierung vorliegt. Dabei stellt sich für höhere Raten automatisch die Frage nach dem geschwindigkeitsbestimmenden Schritt. Auch in der Gasphase bildet sich, wie im Elektrolyten, ein Konzentrationsgradient, wobei sich die Diffusionsrate mit zunehmendem Gesamtdruck verringert. Bei hohen Drücken (und kleineren mittleren Gasmolekülabständen) muss als weiterer Transportprozess, vergleichbar mit dem im Elektrolyten, die (thermische) Konvektion berücksichtigt werden. Auch hier treten bei ausreichend großer angebotener Abscheidefläche, Limitierungen durch den Diffusionsprozess an sich auf.
Neben der Temperatur und der elektrischen Spannung bietet sich auch der Druck als möglicher Parameter an. Hier kann das Haber-Bosch-Verfahren als Beispiel dienen, wo im Durchlaufverfahren unter Nutzung des Le Chatelier-Prinzips die Ausbeute an Ammoniak bei der Synthese aus Wasserstoff und Stickstoff erhöht wird.
Tabelle 1 fasst die Gemeinsamkeiten und Unterschiede zwischen dem chemischen und elektrochemischen Transport nochmals zusammen. Auch ist der Vollständigkeit halber noch ein Vergleich mit Verfahren angestellt, die mit Druckgradienten arbeiten.
Zusammenfassend lassen sich beim Vergleich des chemischen und elektrochemischen Transports ausreichend Gemeinsamkeiten (aber auch aufschlussreiche Unterschiede) finden, die für die galvanische Abscheidung eine solche Bezeichnung rechtfertigen. Es geht dabei aber nicht darum, für altbekannte Dinge zwanghaft neue Namen finden zu wollen, sondern vielmehr den galvanischen Abscheideprozess aus einer anderen, ungewöhnlichen Perspektive zu betrachten, die, so mein Ansinnen, an der einen oder anderen Stelle bereichern und zu neuen Ideen und Ansätzen anregen soll.
|
Gradient |
Transport/ Beschichtung |
Reinigung |
Kristallzucht |
Chemische Synthese |
Aggregatzustand |
|
Spannung |
Galvanostegie/ -formung |
Elektro- raffination |
Elektro- kristallisation |
z. B. Fluor-Herstellung oder Chloralkali- Elektrolyse |
s, (l) |
|
Druck |
– |
– |
– |
z. B. Haber-Bosch- Verfahren |
g |
|
Temperatur |
Chemischer Transport |
Chemischer Transport |
Chemischer Transport |
– |
s |
Literatur
[1] H. Schäfer; H, Jacob; K. Etzel: Z. Anorg. Allg. Chem., 286, 1956, 27
[2] H. Schäfer: Chemische Transportreaktionen, Verlag Chemie GmbH, Weinheim, 1962
[3] H. Schäfer; H, Jacob; K. Etzel: Z. Anorg. Allg. Chem., 286, 1956, 42
[4] US-Patent 2883571
[5] C.J. Smithells: Tungsten, Chapman and Hall, London, 3rd ed., 1952
[6] US-Patent 1267888