[PdCl4]2- + Cl2 ↔ [PdCl6]2-
Das Hexachloridopalladat(IV), das als Kalium- oder Ammoniumsalz relativ schwerlöslich ist, zerfällt bei 60 °C wieder in das gut lösliche Tetrachloridopalladat(II).
Neben den häufiger auftretenden Oxidationsstufen +2 und +4 ist das Palladium seltener auch in den Oxidationsstufen 0 und +5 anzutreffen. Die gefragtesten Palladium-Verbindungen und ihre bekannten Eigenschaften sind in der Tabelle 2 zusammengestellt.
|
Name |
Formel |
Farbe |
M |
Smp. [°C] |
D (20 °C) |
LH2O (20 °C)[g/l] |
Signalwort |
H-Sätze |
|
Pd(II)-Oxid |
PdO |
schwarz |
122,42 |
750 (Z.) |
8,3 |
schwerlöslich |
Gefahr |
272 |
|
Pd(IV).Oxid |
PdO2 |
schwarz |
138,42 |
200 (Z.) |
schwerlöslich |
Achtung |
272‐413 |
|
|
Pd(II)-Sulfid |
PdS |
braun |
138,49 |
950 (Z.) |
6,7 |
schwerlöslich |
Achtung |
315-319-335 |
|
Pd(II)-Fluorid |
PdF2 |
hellviolett |
144.42 |
952 |
5,76 |
Hydrolyse |
||
|
Pd(II)-Chlorid |
PdCl2 |
rotbraun |
177,3 |
590 (subl.) |
4,0 |
schwerlöslich |
Gefahr |
290-302-317‐318‐410 |
|
Pd(II)-Bromid |
PdBr2 |
schwarz |
266,2 |
310 (Z.) |
5,35 |
schwerlöslich |
Achtung |
315‐319‐335 |
|
Pd(II)-Iodid |
PdI2 |
schwarz |
360,2 |
350 (Z.) |
6,0 |
etwas löslich |
Achtung |
317 |
|
Pd(II)-cyanid |
Pd(CN)2 |
gelb |
158,5 |
26 |
2,2 |
schwerlöslich |
Gefahr |
330-310-300-400-410 |
|
Pd(II)-Tetrammin- chlorid |
[Pd(NH3)4]Cl2 |
hellgelb |
245,4 |
gut löslich |
||||
|
Pd(II)-Tetrammin- hydrogencarbonat |
[Pd(NH3)4] (HCO3)2 |
hellgelb |
264,4 |
169-174 |
2,04 |
löslich |
Gefahr |
317-318-372-410 |
|
Diammindichlorido- Pd(II) |
[Pd(NH3)2Cl2] |
gelb |
211,4 |
2,75 |
||||
|
Diammindinitro- Pd(II) |
[Pd(NH3)2(NO2)2] |
hellgelb |
232,5 |
schwerlöslich |
||||
|
Pd(II)-nitrat |
Pd(NO3)2 · 2 H2O |
rotbraun |
266,7 |
Hydrolyse |
Gefahr |
272‐315‐319‐335 |
||
|
Pd(II)-sulfat |
PdSO4 |
rotbraun |
202,5 |
Hydrolyse |
Gefahr |
314 |
||
|
Pd(II)-acetat |
Pd(CH3COO)2 |
goldbraun |
224,5 |
205 (Z.) |
2,19 |
schwerlöslich |
Gefahr |
317-318-319 |
|
Ammoniumhexa- chloridopalladat (IV) |
(NH4)2[PdCl6] |
dunkelrot |
355.2 |
Achtung |
302-315-319 |
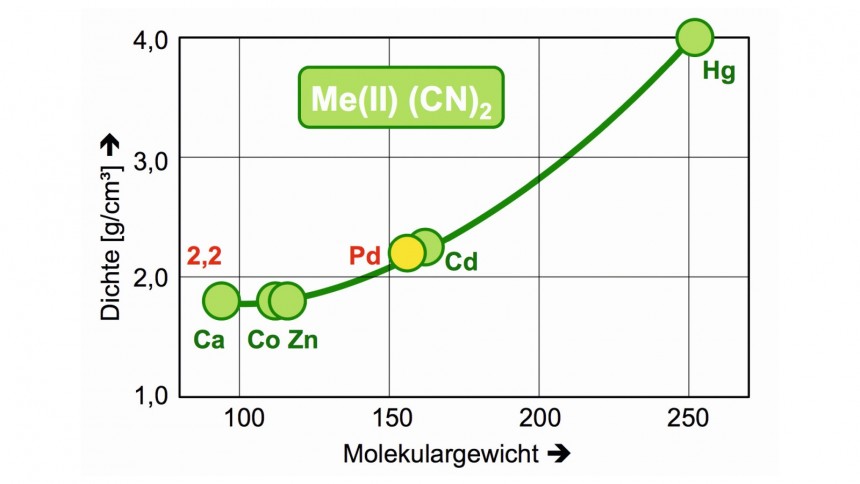
Dabei wurde die Dichte des Palladium(II)cyanids aus den Dichten analoger Verbindungen interpoliert (Abb. 14).
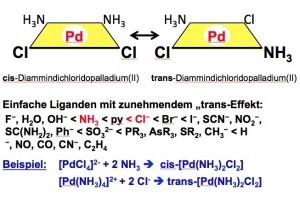 Abb. 15: Selektive Isomeren-Synthese mittels „trans-Effekt“ Da in den Präparate-Betrieben auch die Palladium-Pulver in der Regel aus dem Chlorid hergestellt werden, liegen von Herstellern zahlreiche spezielle Anforderungen und Spezifikationen vor. Denn elektrisch abgeschiedene Pulver haben einen anderen Habitus als chemisch gefällte Pulver mit Formaldehyd, Hydrazin, Boranat oder vielen anderen Reduktionsmitteln unter diversen Parameter-Bedingungen. Viele Palladium-Salze fußen auf den Erkenntnissen, die aus den Experimenten mit den Platin-Verbindungen gewonnen wurden.
Abb. 15: Selektive Isomeren-Synthese mittels „trans-Effekt“ Da in den Präparate-Betrieben auch die Palladium-Pulver in der Regel aus dem Chlorid hergestellt werden, liegen von Herstellern zahlreiche spezielle Anforderungen und Spezifikationen vor. Denn elektrisch abgeschiedene Pulver haben einen anderen Habitus als chemisch gefällte Pulver mit Formaldehyd, Hydrazin, Boranat oder vielen anderen Reduktionsmitteln unter diversen Parameter-Bedingungen. Viele Palladium-Salze fußen auf den Erkenntnissen, die aus den Experimenten mit den Platin-Verbindungen gewonnen wurden.
So konnte der dänische Chemiker Sophus Mads Jørgensen (1837–1914), Sohn eines Scheiderei-Meisters, zeigen, dass das „Vauquelin’sche Salz“, welches von dem französischen Apotheker und Chemiker Louis Nicolas Vauquelin (1763–1829) als erster Palladium-Komplex dargestellt worden war, als eine dem grünen Platinsalz von dem Berliner Physiker und Chemiker Heinrich Gustav Magnus (1802–1870), dem „Magnus-Salz“, analoge Verbindung aufzufassen ist [37]. Das fleischrote „Vauquelin’sche Salz“ [Pd(NH3)4] [PdCl4] ist analog zum grünen „Magnus-Salz“ [Pt(NH3)4] [PtCl4] aufgebaut. Als Kation-Anion-Verbindung im Verhältnis 1:1 sind auch diese Doppel-Komplexe in Wasser relativ schwer löslich. Ebenso schwerlöslich in Wasser verhalten sich generell neutrale Komplexe.
Auch nach den Arbeiten von dem französischen Chemiker J. Reiset (1818–1896) der die Verbindungen Tetramminpalladium(II)-chlorid, (Reiset-Salz I), [Pt(NH3)4]Cl2 und trans-Diammindichloridoplatin(II), (Reiset-Salz II), [Pt(NH3)2Cl2] sowie dem isomereren cis-Diammindichloridoplatin(II), (Peyrone-Salz) des italienischen Chemikers Michele Peyrone (1813–1883) sind auch die entsprechenden Palladium(II)-Komplexe hergestellt worden.
Zur stereoselektiven Herstellung isomerer, planarer cis- und trans-Komplexe entdeckte der russische Chemiker Ilja Iljitsch Tschernjajew (1893–1966) im Jahr 1926 den „trans-Effekt“ [38, 39].
Geht man beispielsweise vom Tetrachloridopalladat(II) aus, erhält man durch Reaktion mit Ammoniak im ersten Schritt den Monoammin-Komplex. Durch die stärkere trans-dirigierende Eigenschaften des Chlorido-Liganden gegenüber dem Ammin-Liganden wird ein zweites Ammoniak-Molekül in trans-Stellung zu einem Chlorido-Liganden eingebaut und somit in cis-Stellung zum ersten Ammin-Liganden (Abb. 15).
Die Oxidationsstufe null des Palladiums ist z. B. im Bis(tri-tert-butylphosphin)palladium(0) (Abb. 16) anzutreffen, das als Katalysator im Einsatz ist und dessen Struktur japanische Wissenschaftler 1992 bestimmten [40].
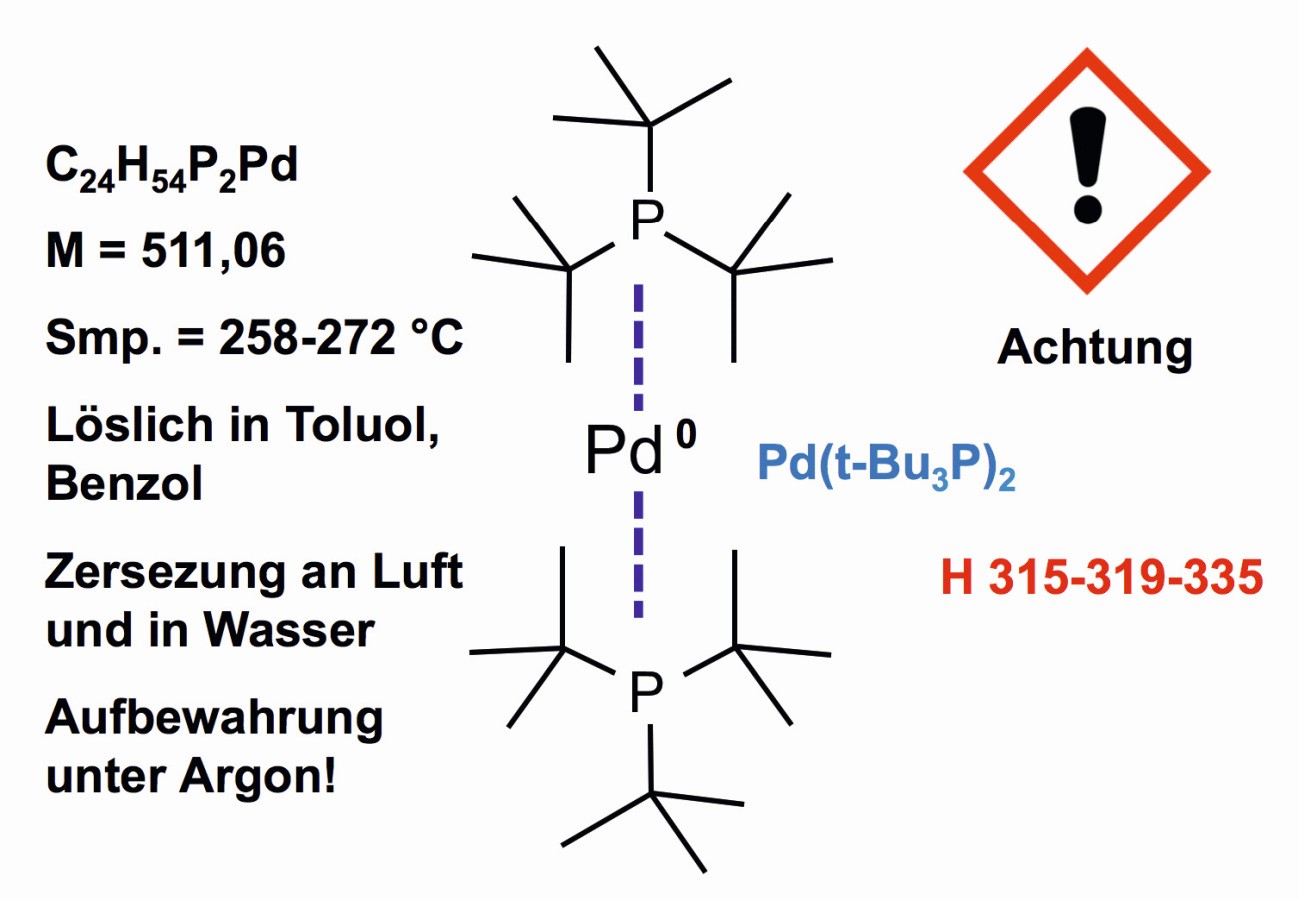 Abb. 16: Palladium in der Wertigkeits-Stufe Null in Bis(tri-tert-butylphosphin)palladium(0)
Abb. 16: Palladium in der Wertigkeits-Stufe Null in Bis(tri-tert-butylphosphin)palladium(0)
Die Verbindung steht auf dem Edelmetall-Präparatemarkt zur Verfügung. Ihre Herstellung erfolgt unter Schutzgas. Die Verbindung spielt eine Rolle unter der neuen Generation von Katalysatoren für organische Synthesen [41].
5.8 Galvanische Bäder
 Abb. 17: Explosive Palladium-VerbindungenDie sehr gute Korrosions- und Temperatur-Beständigkeit macht auch das Palladium für den Einsatz als schützender Überzug unedler Werkstoffe interessant.
Abb. 17: Explosive Palladium-VerbindungenDie sehr gute Korrosions- und Temperatur-Beständigkeit macht auch das Palladium für den Einsatz als schützender Überzug unedler Werkstoffe interessant.
Schwach alkalische Elektrolyte aus der Reihe der leichten Platinmetalle mit Palladium erzeugen eine ähnliche Farbe wie Ruthenium oder Rhodium. Hochglänzende, weiße und sehr dekorative Oberflächen-Schichten bis 0,5 µm sind mit diesen Bädern erreichbar.
Palladium-Bäder eignen sich gut zur Erzeugung von Sperrschichten. Sie finden ihren Einsatz, wenn die Endschicht zum Beispiel Rhodium sein soll, da diese beiden Edelmetalle vom Farbton her sehr ähnlich sind [42].
Die Schmuck- und Brillen-Industrie setzt Palladiumbäder mit 2 g Palladium/Liter für hochglänzende, dekorative und helle Palladium-Schichten bis 0,5 µm Dicke ein.
Auch Edelmetall-Legierungen lassen sich galvanisch abscheiden. So eignet sich eine Silber-Palladium-10-Legierung sehr gut für Steckverbinder-Kontakte, die in hochpoligen oder in Hochtemperatur belasteten Applikationen im Einsatz sind. Der Galvanik-Prozess gestattet eine stabile Prozess-Führung bei gleichbleibenden Schicht-Eigenschaften. Die Schichthärte, der Kontaktwiderstand und die tribologischen Eigenschaften der Legierung sind über längere Zeiträume bis zu 200 °C stabil. Die Vibrations-Festigkeit der Kontaktschicht ist auch mit einer Kontaktierung zu Standardsilber gegeben [43].
Für galvanische Bäder verlaufen oft Bestrebungen, halogenfreie Elektrolyte einzusetzen. Dafür kommt eine Reihe von Nitraten sowie Palladium-Verbindungen mit Ammin- und Nitrito-Liganden zum Einsatz (Abb. 17). Beim Handling und Verarbeiten dieser Verbindungen ist zu beachten, dass sie explosiv reagieren können [44].
6 Palladium-Analysen
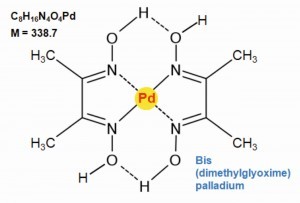
In den analytischen Laboratorien der Edelmetall-Betriebe dominieren die physikalischen Bestimmungsmethoden der Röngenfluoreszenz-Analyse sowie der Multielement-Bestimmungsmethode ICP (Induce Coupled Plasma). Dennoch gilt auch die klassische Fällung mit Dimethylglyoxim als Schiedsanalyse auf Palladium [45].
Durch Dimethylglyoxim wird Palladium(II) quantitativ aus Lösungen von verdünnten Mineralsäuren bei einem pH = 2 als Bis(dimethylglyoximato)-palladium(II) ausgefällt (Abb. 18). In basischem Milieu, bei einem pH-Wert über 9, löst sich der Niederschlag wieder auf.
Die Dimetyhlglyoxim-Nickel- und Platin-Komplexe haben die analoge Zusammensetzung wie die Palladium-Verbindung, jedoch lösen sich diese in Säuren und erlauben so die quantitative Trennung des Palladiums von Nickel und Platin [46, 47].
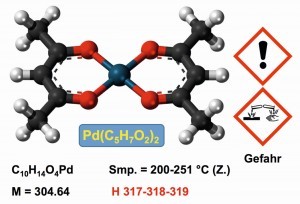
Alternative schwerlösliche Palladium-Verbindungen sind die Neutral-Komplexe mit Acetylacetonat (Abb. 19). Die Verbindung dient auch als Katalysator [48]. Mit fluorierten Acetylacetonat-Liganden lassen sich sogar im Vakuum Metall-Beschichtungen durch thermische Zersetzung durchführen.
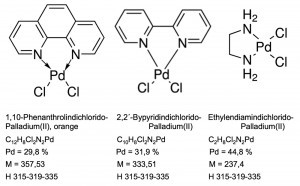
Schon das Diammindichloridopalladium(II), [Pd(NH3)2Cl2], ist bei Raumtemperatur relativ schwer in Wasser löslich. Ersetzt man die Ammoniak-Liganden durch organische Diamin-Verbindungen, wie Ethylendiamindichlorido-Palladium oder 2,2´-Bypyridindichlorido-Palladium wie auch 1,10-Phenanthrolindichlorido-Palladium, lassen sie sich auch im Rahmen quantitativer Fälloperationen analytisch einsetzen (Abb. 20).
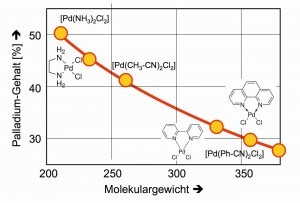
Wiegt man in einem Diagramm die Palladium-Inhalte gegen die Molekulargewichte der schwerlöslichen Komplexe auf, so ist zu erkennen, wie die Größe der Liganden die Resultate der Palladium-Analysen verbessern kann, weil sich Wiegefehler entsprechend geringer auswirken (Abb. 21).
Eine sehr interessante Chemie rankt sich um die Porphyrin-Palladium-Derivate [49], die durch ihre mangelnde Löslichkeit in Wasser, Alkohol, Ether sowie Alkanen quantitative Bestimmungen ermöglichen, denn die Palladium-Inhalte sind in diesen Verbindungen besonders niedrig (Abb. 22). Die Löslichkeit dieser Neutralkomplexe in Acetonitril, Dichlormethan oder Dimethylformamid (DMF) sowie in geringen Mengen auch in Aceton, ermöglicht ebenfalls quantitative photometrische Bestimmungen dieser roten Komplexe, die auch als robuste Photo-Katalysatoren dienen [50].
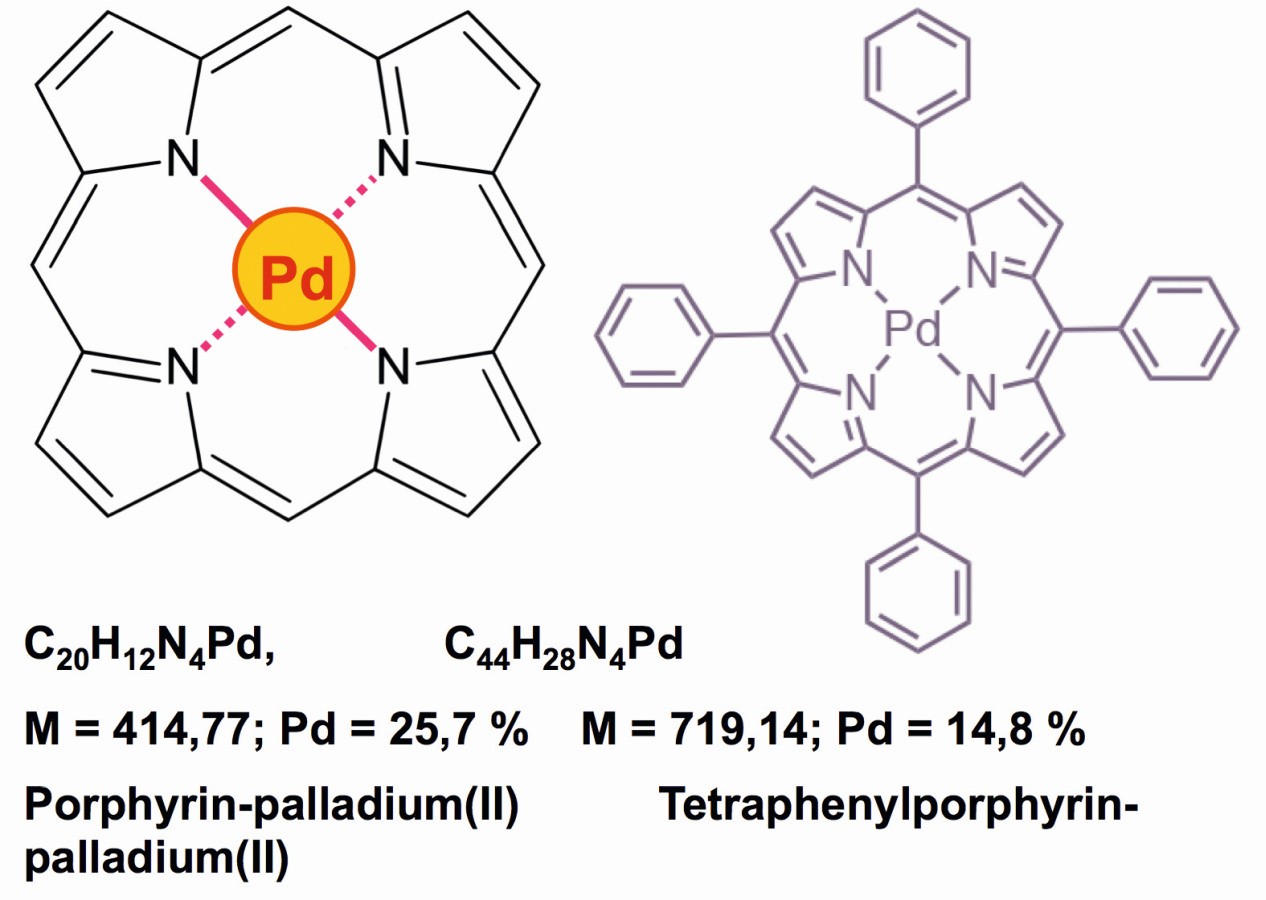 Abb. 22: Rote Porphyrin-Verbindungen des Palladiums
Abb. 22: Rote Porphyrin-Verbindungen des Palladiums
7 Palladium-Recycling
Voraussetzung für ein weitgehendes Recycling sind:
- Recycling-freundliche Konstruktionen
- Hinweise auf den Ressourcen-Erhalt an Palladium-haltigem Scheidgut und Gekrätz
- Optimierte Sammel-Logistik
- Gute Infrastruktur von Aufarbeitungs-Anlagen
- Verfahrens-Optimierungen nach dem Stand der bestverfügbaren Technik
- Ressourcen-Erhalt als Priorität
Bei allen seltenen Element-Ressourcen steht leider die ökonomische Komponente an erster Stelle. Das führt zu erheblichen Verlusten: aus Bequemlichkeit, Unwissenheit, technischen und logistischen Unzulänglichkeiten und Unfällen.
Eine Bilanz der Stoffströme zur Aufarbeitung der Palladium-Rückstände aus Produktion und Verbraucher zeigt die Abbildung 23 für das Jahr 2015. Der größte Anteil an Palladium-Rückläufen entfällt mit Abstand auf Katalysatoren, Elektronik-Bausteine und Altfahrzeuge [51].
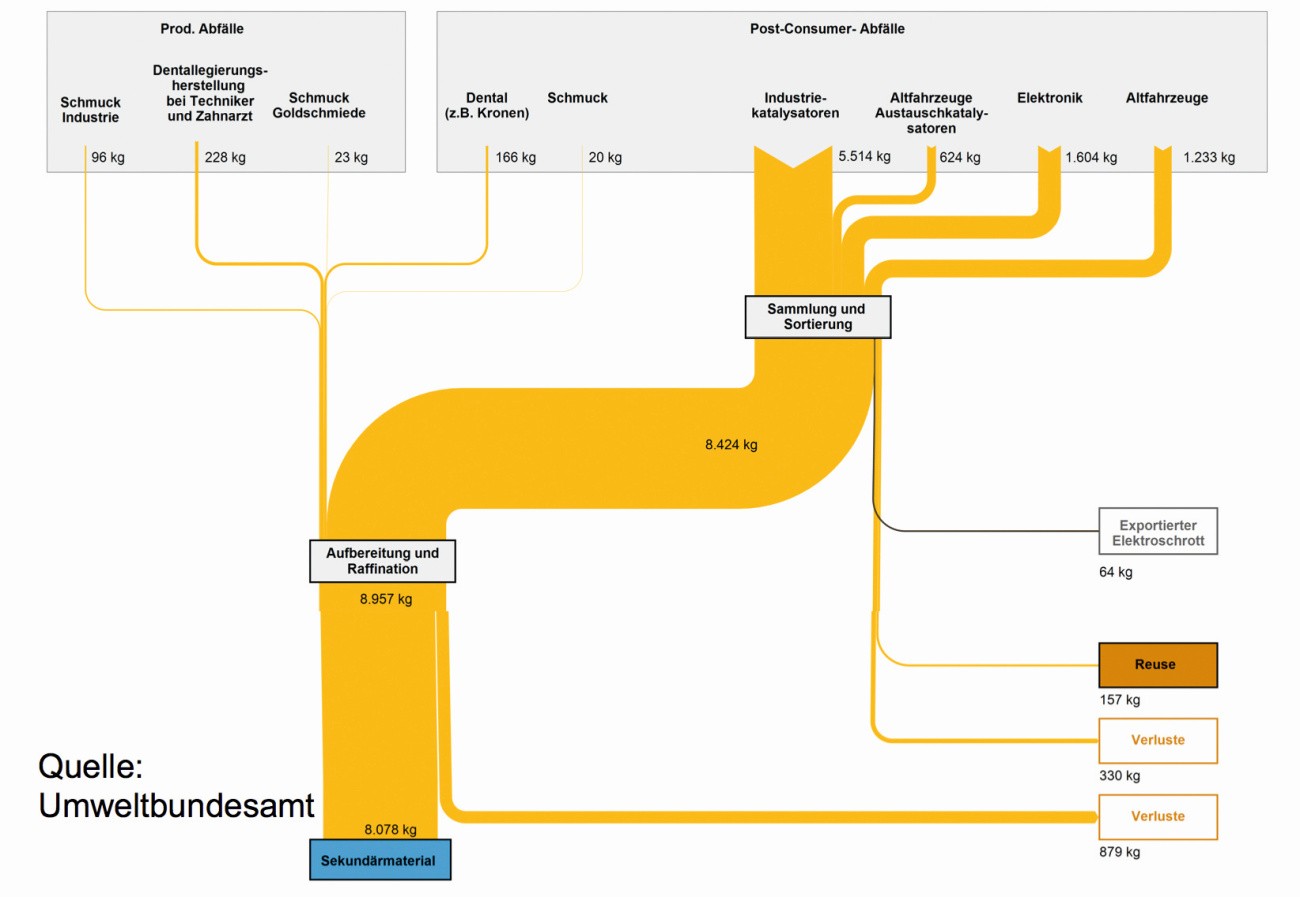 Abb. 23: Stoffströme der Verwertung von Palladium in Deutschland 2015
Abb. 23: Stoffströme der Verwertung von Palladium in Deutschland 2015
Alleine auf den langen Wegen des Palladium-Gebrauches verschwinden 10 bis 30 % des Metalls: Von den Chemie-Katalysatoren auf den verschiedenen Trägern, wie Aktivkohle, Kalziumcarbonat u.a. verliert sich ein Teil in das Produkt, von den Elektronik-Bausteinen landen viele auf dem Restmüll oder auf Deponien, wo das Palladium für immer verloren ist. Bei den Autoabgas-Katalysatoren kommt es auf die Fahrweise der Fahrzeug-Besitzer an, wie weit die „Washcoat“ mit den Edelmetallen aus dem Auspuff gefegt wird. Bei tiefer gelegten Pkw mit einigen Aufschlägen des Unterbaus an Bordsteinen und Straßen-Un- ebenheiten sowie Geschwindigkeiten über 200 km/h verbleibt sicherlich nicht viel an Katalysator-Keramik im Abgas-System.
Das Bundesministerium für Umwelt, BMU, gab 2016 eine Recherche in Auftrag zu den Ressourcen für das Jahr 2020. Aus den analysierten Produkten ergibt sich anhand der Referenz- bzw. Mittelwerte eine insgesamt zu erwartende Palladium-Menge von 14 201 kg im Jahr 2020. Die Spannbreite der ermittelten Menge reicht von 13 737 bis 14 664 kg. Die größten Beiträge kommen mit 10 307 kg von verbrauchten Industrie-Katalysatoren, gefolgt von Autokatalysatoren mit 3578 kg. Rechenzentren tragen mit rund 316 kg nur geringfügig zum Palladium-Recycling bei [52].
Für die Aufarbeitung von Palladium-Rückständen existieren bei den Edelmetall-Scheidereien auf das Eingangsmaterial mehr oder weniger abgestimmte Trennungsgänge. Mitunter reicht eine Hochtemperatur-Chlorierung von Legierungen bei 800 °C aus, um sie von den Unedelmetall-Spuren zu befreien. Aus stark von Unedelmetallen begleiteten Edelmetallen kommen z. B. Hydrazinfällung der Edelmetalle oder Ionenaustausch-Prozesse zum Einsatz.
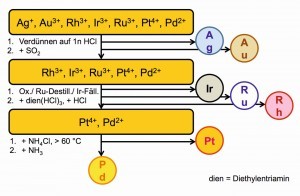
Liegen neben dem Palladium noch andere Edelmetalle vor, kommen spezifische oder generelle Trennungsgänge dran [53–57].
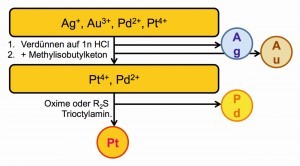
Das kann ein Edelmetall-Trennungsgang mit überwiegend selektiven Fällungen sein (Abb. 24) oder Trennungen über Flüssig-flüssig-Extraktionen zwischen den Medien Wasser und Benzin oder anderen organischen, mit Wasser nicht mischbaren Lösungsmitteln (Abb. 25).
Die Abtrennung des Palladiums erfolgt in der Regel über das schwerlösliche Ammoniumhexachlorido-palladat(IV), (NH4)2[PdCl6]/Cl2, durch Oxidation mit Chlorgas. Eigenartigerweise verliefen diese Fällungen stets ohne Zwischenfälle.
Am Forschungsinstitut in Freiberg zeigten analoge Versuche, dass sich als Nebenreaktion dieser Präzipitation Stickstofftrichlorid, NCl3, bildet, eine äußerst explosive Verbindung [58]. Das bei Raumtemperatur ölige Stickstofftrichlorid sammelt sich mit einer Dichte von 1,64 am Reaktorboden, zeigt jedoch mit einem Siedepunkt von 71 °C die annähernde Flüchtigkeit von Alkohol.
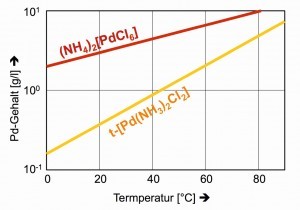
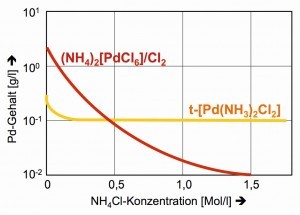
Die Schwerlöslichkeiten der klassischen Präzipitate im Trennungsgang, des dunkelroten (NH4)2[PdCl6] und des gelben trans-[Pd(NH3)2Cl2] zeigen sich nur bei tieferen Temperaturen zufriedenstellend (Abb. 26).
Die Löslichkeit des Hexachlorido-palladats(IV) lässt sich durch Ammoniumchlorid noch weiter herabsetzten, eine gängige Methode des Aussalzens, die bei dem Neutralkomplex [Pd(NH3)2Cl2] naturgemäß versagt (Abb. 27).
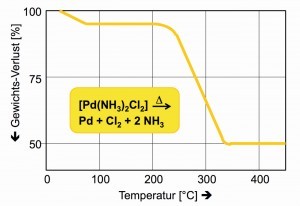
Die thermische Zersetzung des Diammindichlorido- Palladiums(II) im Temperatur-Bereich von 600 bis 800 °C garantiert eine sichere Methode zum Erhalt grobkristallinen Palladiums, auch „Palladium-Schwamm“ genannt (Abb. 28).
Gerade in Forschungs-Instituten und kleineren Betrieben kommen die Techniker bei geringeren Palladiumsalz-Mengen in Versuchung, Fällungen mit Ameisensäure, Formiat, Hydrazin oder Boranat ohne Sicherheits-Vorkehrungen vorzunehmen. Zum Einen sind die feinen Palladium-Metallpulver durch Aufnahme von Wasserstoff pyrophor, zum anderen setzen die Reduktionsmittel selbst Wasserstoff frei, wie z. B. die Ameisensäure, deren Gefahrstoff-Eigenschaften selbst schon eine Herausforderung darstellt [59]:
H2[Pd2+Cl4] + H-C2+O-OH → Pd0 + C4+O2 + 4 HCl
H-CO-OH → CO2 + H2 (Palladium-katalysierte Reaktion!).
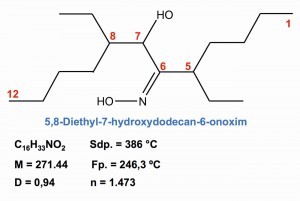 Abb. 29: Extraktion von Palladium mit Oximen Bei der selektiven Abtrennung des Palladiums von anderen Metallen haben die Extraktionen mit Oximen und Dialkylthioethern an Bedeutung gewonnen. Eine speziell für Palladium entwickelte Extraktions-Chemikalie ist das 5,8-Diethyl-7-hydroxydodecan-6-onoxim, dessen formale Molekül-Struktur und Eigenschaften die Abbildung 29 aufzeigt.
Abb. 29: Extraktion von Palladium mit Oximen Bei der selektiven Abtrennung des Palladiums von anderen Metallen haben die Extraktionen mit Oximen und Dialkylthioethern an Bedeutung gewonnen. Eine speziell für Palladium entwickelte Extraktions-Chemikalie ist das 5,8-Diethyl-7-hydroxydodecan-6-onoxim, dessen formale Molekül-Struktur und Eigenschaften die Abbildung 29 aufzeigt.
Bei den Di-n-Alkylthioethern sind vor allem die Di-n-Hexyl- und Di-n-Octylthioether im betrieblichen Einsatz. Wie der Tabelle 1 zu entnehmen ist, nimmt die Löslichkeit in der Reihe der Thioether mit zunehmendem Molekulargewicht ab, zum anderen liegen die Flammpunkte bei hohen Molekulargewichten im sicheren Bereich.
Nach der Reextraktion mit konzentrierter Salzsäure liegt wieder das Tetrachloridopalladat(II) vor, das mit Ammoniak als [Pd(NH3)2Cl2] gefällt und kalziniert wird.
8 Die Zukunft des Palladiums
Palladium entwickelte sich für Anleger als der „Strahlende Stern“ unter den Metallen, denn sie konnten sich in den letzten Jahren jeweils auf zweistellige Wert-Zuwachsraten freuen. Steigende Nachfragen sowie strengere Umweltvorschriften für Fahrzeuge in China und die Umstellung von Diesel- auf Benzin-Autos in Europa lassen eine rosige Zukunft für Palladium erwarten. Auch die begrenzte Palladium-Produktion, zusammen mit der Unterversorgung in den vergangenen Jahren, kann die Preise weiter in die Höhe treiben.
Die positiven Prognosen reichen bis in das Jahr 2024, in dem der Palladium-Preis 3400 US-Dollar/Feinunze (31,1g) erreichen soll [60].
Andere Börsianer sehen in der Flaute, die weltweit in der Autoindustrie herrscht, ein Ende des Palladium-Booms. Da dort fast 85 % des global geförderten Palladiums in Katalysatoren von Benzin-Fahrzeugen landen, ging die Nachfrage nach diesem Edelmetall durch den weitgehenden Stillstand des Automarktes während des Corona- Lockdowns drastisch zurück. Von dem kräftigen Preisrückgang von 2800 auf 1600 US-Dollar/Feinunze hat sich der Palladium-Preis bisher nur wenig erholt.
Die Befürchtung, dass durch die Zunahme von Elektroautos weniger Palladium benötigt wird, dürfte vorerst unbegründet sein. Der Markt für batteriebetriebene Fahrzeuge läuft trotz der Subventionen nur sehr langsam an. Die Zukunft der Hybridfahrzeuge sieht da schon besser aus. Und die benötigen sogar 10 bis 15 % mehr Palladium als die herkömmlichen Fahrzeuge [61].
Literatur
[1] Weeks, M.E.: Discovery of the Elements, Journal of Chemical Education, 6. Aufl. (1956) 409
[2] https://de.wikipedia.org/wiki/(2)_Pallas
[3] Wollaston, W.H.: On a New Metal, Found in Crude Platina, Phil. Trans. R. Soc. 94 (1804) 419–430
[4] Graham, Th.: On the relation of hydrogen to palladium, Proceedings of the Royal Society of London. 17 (1869) 212–220
[5] Phillips, F.C.: Am. Chem. J., 16 (1894) 255–277
[6] Edelmetall-Taschenbuch, Degussa (1967) 72
[7] http://forkat.anorg.chemie.tu-muenchen.de/biblio/texte/pdf
[8] Edelmetall-Taschenbuch, Degussa, Hüthig (1995)
[9] https://www.wotech-technical-media.de/womag/ausgabe/2013/10/21_w_edelmetalle_schade_10j2013/21.php
[10] Edelmetall-Taschenbuch, Degussa (1967) 70
[11] https://de.wikipedia.org/wiki/Platinmetalle/Tabellen_und_Grafiken
[12] https://de.wikipedia.org/wiki/Palladium
[13] Holleman; Wiberg: Anorganische Chemie, Bd. 2, 103. Aufl. (2017) 2039
[14] https://de.wikipedia.org/wiki/Thioether
[15] https://www.kettner-edelmetalle.de/Palladium
[16] https://www.scheideanstalt.de/aktuelle-ankaufskurse/palladium/
[17] https://www.handelsblatt.com/finanzen/maerkte/devisen-rohstoffe/rohstoffe-warum-der-palladium-preis-seit-jahresbeginn-explodiert/
[18] https://feingoldhandel.de/palladium-das-silberweisse-edelmetall
[19] Aston, J.G.; Mitacek, P., Jr.: Structure of hydrides of palladium, Nature, London, UK., 195 (1962) 70–71
[20] https://www.pv-magazine.de/2017/09/01/solarstrom-wirtschaftlich-in-wasserstoff-umwandeln/
[21] https://www.seilnacht.com/Lexikon/swasser.html
[22] https://de.wikipedia.org/wiki/Anthrachinon-Verfahren
[23] Kickelbick, G.: Chemie für Ingenieure, Pearson Deutschland, (2008) 155
[24] https://de.wikipedia.org/wiki/Herbert_Lindlar
[25] Rosenmund, K.W.: Über eine neue Methode zur Darstellung von Aldehyden, 1. Mitteilung, Berichte der deutschen chemischen Gesellschaft. 51 (1918) 585–593
[26] Steinborn, D.: Grundlagen der metallorganischen Komplexkatalyse, Teubner, Wiesbaden (2007) 283–292
[27] https://www.chemhui.com/pro/37668
[28] Yang, J.; Liu, J.; Neumann, H.; Franke, R.; Jackstell, R.; Beller, M.: Direct synthesis of adipic acid esters via palladium-catalyzed carbonylation of 1,3-dienes, Science, 366 (2019) 1514
[29] https://goetze-gold.de/halbzeuge-zuschnitt/blech/platin-und-palladium/
[30] https://www.wegold.de/produkte/legierungen/palladium-basis-legierungen/676-wegold-dg-dentallegierung
[31] https://de.wikipedia.org/wiki/Dentallegierungen
[32] https://www.edelmetalle.org/medizintechnik/
[33] https://www.aerogen.com/de/technologie/
[34] https://patents.google.com/patent/DE60003490T2/de
[35] https://www.edelmetalle.org/elektronik/
[36] Buth, M.A.: Palladium aus PC und Elektronik, Sonderband, adrenalinemedia (2012)
[37] RÖMPP, Lexikon Chemie, 8.Aufl., Bd. 4 (1985) 2973
[38] https://de.wikipedia.org/wiki/Ilja_Iljitsch_Tschernjajew
[39] https://de.wikipedia.org/wiki/Trans-Effekt
[40] Tanaka, M.: Structure of Bis(tri-tert-butylphosphin)palladium(0), Acta Cryst., C48 (1992) 739–740
[41] He, L.-Y.: Bis(tri-tert-butylphosphine)palladium(0) [Pd(t-Bu3P)2], Synlett, 26/6 (2015) 551–852
[42] https://shop.jentner.de/galvanische-elektrolyte/edelmetall-elektrolyte/Palladiumbad/
[43] Talgner, F., Myers, M.; Schmidt, H.: Galvanisch Silber- Palladium als Kontaktoberfläche, Galvanotechnik, Leuze-Verl., 05 (2017) 910
[44] Hasenpusch, W.: Explosivität von Tetramminmetall-nitraten, J. prakt. Chem, Chemiker-Zeitung 335 (1993) 193–196
[45] Chemiker-Fachausschuss d. Gesellschaft Metall und Erz: Analyse der Metalle I: Schiedsverfahren, Springer-Verl., Berlin (1942) 184
[46] Burger, K., Dyrssen, D.; Johansson, L.; Norén, B.; Munch-Petersen, J.: On the Complex Formation of Palladium with Dimethylglyoxime, Acta Chemica Scandinavica, 17 (1963) 1489
[47] Fries, J.; Getrost,H.: Merck, E., Darmstadt: Organische Reagenzien für die Spurenanalyse“ (1975) 285
[48] https://en.wikipedia.org/wiki/Palladium(II)_bis(acetylacetonate)
[49] Setsune, J.: Palladium chemistry in recent porphyrin research Journal of Porphyrins and Phthalocyanines, 08/01(2004) 93–102
[50] To, W.; Liu, Y.; Lau, T.; Che, C.: A Robust Palladium(II)-Porphyrin Complex as Catalyst for Visible Light Induced Oxidative C-H Functionalization, Chemistry – A European Journal, 19/18 (2013)
[51] https://www.umweltbundesamt.de/platin-palladium#hinweise-zum-Recycling
[52] https://www.bmu.de/fileadmin/Daten_BMU/Pools/Forschungsdatenbank/fkz_3711_93_339_substitutionspotenziale_Metalle_bf.pdf
[53] Edelmetalltaschenbuch, Degussa AG, Frankfurt, Hüthig- Verl. Heidelberg (1995) 48
[54] Doduco-Datenbuch, Pforzheim (1974) 351
[55] Bertau, M.; Müller, A.; Fröhlich, P.; Katzberg, M.: Industrielle Anorganische Chemie, 4. Aufl., Wiley-Verl., Weinheim (2013) 363–371
[56] Metall Forschung und Entwicklung, Degussa AG (1991) 33–44
[57] Annual Seminar Proceedings of the International Precious Metals Institute, IPMI, USA
[58] Knothe, M.; Hasenpusch, W.: The formation of explosive chlorine-nitrogen compounds during the processes of precious metals separation, Journal of Hazardous Materials, 56 (1997) 137–148
[59] https://de.wikipedia.org/wiki/Ameisensaeure
[60] https://capital.com/de/palladium-preisentwicklung
[61] https://www.boerseonline.de/nachrichten/rohstoffe/voruebergehende-flaute-warum-der-palladium-preis-bald-wieder-steigen-duerfte-102934254