Biologisch abbaubare Materialien ziehen schon seit ein paar Jahren die Aufmerksamkeit der Wissenschaftler und Mediziner für die Verwendung von Implantaten in der rekonstruktiven Medizin auf sich. Im Rahmen eines internationalen Forschungsprojektes wurden die biokompatiblen Beschichtungen auf einer MgCa1- Legierung mit Hilfe der plasmachemischen Oxidation (PCO) gebildet und ihre Morphologie, Struktur, Phasenzusammensetzung, Korrosion und biologischen Eigenschaften untersucht. Die beschichteten Proben wiesen im Vergleich zu einer unbeschichteten Magnesiumlegierung bemerkenswerte Korrosionsschutzeigenschaften auf, sie beeinträchtigten die Lebensfähigkeit der Zellen nicht und waren gemäß ISO 10993-5: 2009 nicht toxisch.
Hohes Interesse an Magnesiumlegierungen
In der Medizin wird der regenerative Ansatz immer wichtiger, so dass die Nachfrage nach orthopädischen Implantaten mit bioaktiven und antibakteriellen Beschichtungen hoch bleibt. Für die Medizintechnik interessant sind implantierbare Systeme, welche mit der Zeit resorbierbar sind und durch neues Knochengewebe ersetzt werden können. Aus diesem Grund haben Magnesiumlegierungen in letzter Zeit stark an Aufmerksamkeit gewonnen. Der wachsende Markt für Implantate erfordert hochentwickelte biologisch abbaubare Magnesiumlegierungen mit kontrollierbarer Auflösungsrate.
Aufgrund ihrer spezifischen Festigkeit und Steifigkeit, ihrer geringen Dichte, ihrer knochenähnlichen mechanischen Eigenschaften [1], ihrer Biokompatibilität und ihres Abbauverhaltens [2–6] werden Magnesiumlegierungen in verschiedenen Bereichen wie der Orthopädie und dem Herz-Kreislauf-System eingesetzt. Trotz all dieser positiven Eigenschaften weisen die Magnesiumlegierungen noch eine zu hohe Korrosionsrate auf, so dass die Degradation bereits vor dem Ende des Heilungsprozesses einsetzt, die antibakteriellen Eigenschaften sind noch nicht ausreichend ausgebildet und während des Korrosionsprozesses / Degradationsprozesses wird Wasserstoff freigesetzt. Dieser führt zu einem Anstieg des pH-Werts im Bereich des umgebenden Gewebes und kann Apoptose und Nekrose von Gewebezellen auslösen [7, 8].
Im Laufe der Jahre wurden verschiedene Möglichkeiten zur Verbesserung der Leistung von Magnesiumlegierungen vorgeschlagen:
- durch Legieren mit korrosionshemmenden Elementen
- durch mechanische Vorbehandlung
- durch Oberflächenbehandlung [5, 9, 10].
Die erste Methode ist chronologisch gesehen die älteste Methode. Dabei werden der Magnesiumlegierung verschiedene Elemente wie Al, Zn, Mn, Si, Sr, Zr, Cu und seltene Erden hinzugefügt, um verschiedene mechanische, physikalische und chemische Eigenschaften der Legierung zu verbessern [3, 4, 6, 9–14]. Kalzium wird zudem auch in Magnesiumlegierungen verwendet, um das Gefüge zu verfeinern und die thermische Stabilität der β-Phase zu erhöhen, was zu einer Verbesserung der Streckgrenze und der Kriechfestigkeit führt [15–17].
Die Oberflächenbehandlung von Magnesiumlegierungen ist eine vielversprechende Möglichkeit, die Korrosionsrate zu beeinflussen oder auch zu steuern. So wurden zahlreiche Oberflächenbehandlungsmöglichkeiten für Magnesiumlegierungen untersucht, aber die am häufigsten verwendete Methode ist die Beschichtung von Magnesiumlegierungen mit dem Verfahren der Plasmachemischen Oxidation (PCO) oder auch als Micro Arc Oxidation (MAO) bzw. plasmaelektrolytische Oxidation (PEO) bezeichnet. Surmenev hat eine Übersichtsarbeit veröffentlicht, in der alle Methoden zur Herstellung von CaP- Beschichtungen mit ihren Vor- und Nachteilen gut beschrieben sind [18].
Plasmachemische Oxidation
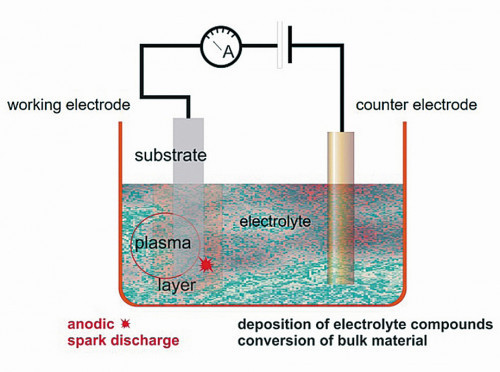
Auch in diesem internationalen Forschungsprojekt wurde die Plasmachemische Oxidation (PCO) für die Beschichtungsherstellung ausgewählt. Das PCO-Verfahren ist zwischen der Plasmaphysik und der Galvanik einzuordnen und erzeugt Oberflächenentladungen an der Anode und die Bildung eines Dielektrikums in einem wässrigen Elektrolyten. Die Hauptmerkmale dieser Entladung sind die Bildung von Oxid aus dem Substratmaterial und der Einbau zusätzlicher Elektrolytkomponenten in die Schicht. So ist es möglich, die Schichteigenschaften in weiten Grenzen sowohl durch die elektrischen Parameter als auch durch die chemische Zusammensetzung des Elektrolyten zu variieren. Mit keinem anderen Verfahren der anodischen Oxidation gelingt es so, die Schichteigenschaften durch die Zusammensetzung des Elektrolyten zu beeinflussen und gezielt erwünschte Elemente / Verbindungen in die gebildete Schicht einzubauen. So war u.a. auch ein Ziel des Forschungsprojektes, CaP-Beschichtungen für die Magnesiumlegierung MgCa1 zu erzeugen, die zusätzlich einen Zinkanteil aufweisen sollten. Das Element Zink wurde ausgewählt, weil es hohe antibakterielle Eigenschaften gegen verschiedene Arten von Bakterien oder Pilzen aufweist [9, 14, 19–21]. Diese so dotierten Schichten wurden bereits in anderen Publikationen des Forschungsprojektes umfassend charakterisiert [22], so dass an dieser Stelle nur ein kurzer Überblick über die wesentlichen Ergebnisse gegeben werden soll.
Die für diese Untersuchungen genutzte MgCa1-Legierung wurde bei der Helmholz Zentrum Hereon GmbH in Geesthacht als Barren mit einem Durchmesser von 60 mm und einer Länge von 170 mm hergestellt. Die Blöcke wurden dann durch Strangpressen weiterverarbeitet, um Stäbe mit einem Durchmesser von 15 mm zu erhalten. Durch mechanische Bearbeitung (CNC-Drehen) wurden die Stäbe in 3 mm dicke Proben geteilt, so dass die für die entsprechenden biologischen Tests und Untersuchungen vorteilhafte Probenabmessung von Ø 15 x 3 mm erhalten wurde (Abb. 1).
|
Elektrolytbezeichnung |
Hauptkomponenten |
|
CaP |
*Kaliumdihydrogenphosphat [KH2PO4] *Ammoniumdihydrogenphosphat [NH4H2PO4] *Natrium – Calcium – EDTA [C10H12N2O8CaNa2] |
|
CaP+Zn |
*Kaliumdihydrogenphosphat [KH2PO4] *Ammoniumdihydrogenphosphat [NH4H2PO4] *Natrium – Calcium – EDTA [C10H12N2O8CaNa2] *Zinknitrat [Zn(NO3)2] |
Für die Funktionalisierung der Proben aus der MgCa1- Legierung wurde das PCO-Verfahren und speziell dafür synthetisierte Elektrolyte verwendet. Die schematische Darstellung des Verfahrens ist in Abbildung 2 zu sehen. Für die Beschichtung wurden die in Tabelle 1 aufgeführten Elektrolyte mit ihren jeweiligen funktionsbestimmenden Hauptbestandteilen verwendet. Alle Beschichtungen wurden mit einem gepulsten bipolaren Stromgenerator mit einer Pulsdauer von 1 ms durchgeführt. Das Verhältnis von anodischer zu kathodischer Ladungsmenge wurde auf einen Wert von 1 eingestellt. Die anodische Stromdichte wurde mit 5 A/dm2 eingestellt. Der Parameter zur Beendigung des Beschichtungsprozesses wurde mit der Badspannung definiert, bei der eine gewünschte Schichtdicke von 10 µm erreicht wurde. Unabhängig von der Beschichtungszeit wurde der Prozess beendet, wenn der eingestellte Strom auf 50 % des Ausgangsstroms abgesunken war. Diese zweigeteilte Arbeitsweise, in der die erste Phase des PCO-Prozesses durch eine galvanostatische Polarisation und die zweite Phase durch einen potentiostatische Polarisation geprägt ist, hat sich in allen bisher durchgeführten Untersuchungen positiv auf die Eigenschaften der PCO-Schichten ausgewirkt.
Charakterisierung
Die elektrochemischen Tests wurden mit einem Potentiostat / Galvanostat VersaSTAT 3 (Princeton Applied Research, USA) durchgeführt und die Daten wurden mit der Software VersaStudio gemäß der Norm ASTM G5-94 aufgezeichnet. Als Elektrolyt wurde eine SBF-Lösung (pH=7,2) mit 37±0,5 °C verwendet. Als Ergebnis dieser elektrochemischen Korrosionsuntersuchungen wurden anhand von Tafelkurven die wichtigsten elektrochemischen Parameter extrahiert und in Tabelle 2 dargestellt. Die Auswertung dieser Parameter zeigt, dass die beiden beschichteten Varianten eine bessere Korrosionsbeständigkeit aufweisen als das unbeschichtete MgCa1-Substrat, wobei die Variante MgCa1_CaP+Zn den niedrigsten Wert der Korrosionsstromdichte aufweist. Es folgte die Variante MgCa1_CaP, die der unbeschichteten MgCa1-Legierung sehr ähnlich war. Bei der Polarisationsbeständigkeit (Rp) wurde der höchste Wert für die Zn-dotierte Beschichtung festgestellt, was darauf hindeutet, dass diese Dotierung der CaP-Beschichtung die Korrosionsbeständigkeit erheblich verbessert. Unter Berücksichtigung des Wertes der Korrosionsstromdichte der beschichteten Proben und des unbeschichteten MgCa1-Substrates wurde die Schutzwirkung (Pe) gegen SBF-Angriffe auf der Grundlage des in den Referenzen beschriebenen Verfahrens berechnet. [12, 23–25]. Aus dem Vergleich der Ergebnisse geht klar hervor, dass die Zn-Dotierung einen hohen Schutz gegen SBF-Angriffe im humanen Körper bieten kann. Die Zytotoxizität der Proben wurde durch indirekte Tests mit Proben-Extrakten bestimmt; beschrieben wird dies in [22].
|
Probenbezeichnung |
Ecorr (V) |
icorr (µA cm−2) |
Rp (Ωcm2) |
|
MgCa1 (Substrat) |
-1.558 |
994.519 |
56.9165 |
|
MgCa1_CaP |
-1.554 |
376.842 |
92.8275 |
|
MgCa1_CaP+Zn |
-1.372 |
78.348 |
1952.110 |
Ergebnisse
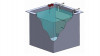
 Abb. 3: Typische FunkenentladungDer PCO-Beschichtungsprozess führte bei beiden Beschichtungsvarianten zu einer raueren, poröseren und hydrophileren Oberfläche im Vergleich zum unbeschichteten Substratwerkstoff. Dies begünstigte die Anhaftung und das Wachstum der untersuchten Zellen. Alle Proben erwiesen sich als cytokompatibel. Die in-vitro-Kultivierung der Proben mit Saos-2-Zellen führte zu einigen Veränderungen in der elementaren Zusammensetzung der Legierungen aufgrund ihrer Biodegradation. Die Zn-dotierten Beschichtungen enthielten zwischen 0,94 und 1,16 Atom-% Zn.
Abb. 3: Typische FunkenentladungDer PCO-Beschichtungsprozess führte bei beiden Beschichtungsvarianten zu einer raueren, poröseren und hydrophileren Oberfläche im Vergleich zum unbeschichteten Substratwerkstoff. Dies begünstigte die Anhaftung und das Wachstum der untersuchten Zellen. Alle Proben erwiesen sich als cytokompatibel. Die in-vitro-Kultivierung der Proben mit Saos-2-Zellen führte zu einigen Veränderungen in der elementaren Zusammensetzung der Legierungen aufgrund ihrer Biodegradation. Die Zn-dotierten Beschichtungen enthielten zwischen 0,94 und 1,16 Atom-% Zn.
Die Anzahl der Zellen, die an der Oberfläche von Zn- dotierten Beschichtungen hafteten (2,6 × 104 Zellen/cm2), war höher als die Anzahl der Zellen, die an der Oberfläche der undotierten Beschichtung hafteten (1,0 × 103 Zellen/cm2). Die Haftung der CaP-Beschichtung auf dem Substrat aus MgCa1-Legierung wurde durch den Zn-Zusatz verbessert. Die Dotierung mit Zn beeinflusste auch die Mikrostruktur der CaP-Beschichtung, was sich wiederum auf die mechanischen Eigenschaften auswirkte. Die Härte der Beschichtung betrug 4,58 GPa bei der Variante MgCa1_CaP bzw. 1,62 GPa bei der Variante MgCa1_CaP+Zn, während beim Elastizitätsmodul die Werte 81,90 GPa der Variante MgCa1_CaP und 60 GPa bei der Variante MgCa1_CaP+Zn gemessen wurden. Im Ergebnis wird durch die Beschichtung ein Material erzeugt, das während der Belastung einer plastischen Verformung standhält. Die Beschichtungshaftung auf dem Substrat wurde durch die Zn-Dotierung verbessert.
Diese Variante zeigte unter in-vitro-Bedingungen nur eine minimale Veränderung der Beschichtung, was eine nachhaltige Korrosionsschutzwirkung bei langfristiger Verwendung unter physiologischen Bedingungen verspricht. Zusammenfassend lässt sich sagen, dass die in diesem Forschungsprojekt entwickelten CaP-beschichteten und Zn-dotierten Magnesium-Calcium-Legierungen neuartige und vielversprechende Kandidaten für biologisch abbaubare metallische Knochengewebeimplantate in Bezug auf Korrosionsbeständigkeit und Osteokonduktivität sein können.
Zusammenfassung
Die in diesem Forschungsprojekt durchgeführten Experimente und die daraus resultierenden Ergebnisse lassen folgende Schlussfolgerungen zu:
• Beschichtungen auf CaP-Basis können mit dem PCO Verfahren erzeugt werden. Durch eine Zn-Dotierung können die für degradierbare Implantate notwendigen Eigenschaften positiv beeinflusst werden.
• Bei den elektrochemischen Tests wurde das beste Verhalten in der folgenden Reihenfolge festgestellt:
– MgCa1_CaP+Zn > MgCa1_CaP > MgCa1
– Die Beschichtung mit einer Zn-Dotierung zeigte den besten Korrosionsschutz in SBF-Lösung bei 37 °C
– Die mit Zn-dotierten Beschichtungen zeichnen sich durch eine stärkere negativ geladene Oberfläche aus als die undotierten Beschichtungen der Proben. Die elektrische Ladung der Zn-dotierten Beschichtungen ist im Vergleich zu den undotierten am stabilsten.
Literatur
[1] A. Abdal-Hay; M. Dewidar; J.K. Lim: Biocorrosion behavior and cell viability of adhesive polymer coated magnesium based alloys for medical implants, Appl. Surf. Sci. 261 (2012) 536–546, https://doi.org/10.1016/j.apsusc.2012.08.051
[2] Witte: The history of biodegradable magnesium implants: A review, Acta Biomater. 6 (2010) 1680–1692, https://doi.org/10.1016/j.actbio.2010.02.028
[3] H.S. Brar; M.O. Platt; M. Sarntinoranont; P.I. Martin; M.V. Manuel: Magnesium as a biodegradable and bioabsorbable material for medical implants, JOM. 61 (2009) 31–34, https://doi.org/10.1007/s11837-009-0129-0
[4] Y. Zheng: Magnesium Alloys as Degradable Biomaterials, 2015, https://doi.org/10.1201/b18932
[5] W.H. Sillekens; D. Bormann: Biomedical applications of magnesium alloys, in: Adv. Wrought Magnes. Alloy., 2012, https://doi.org/10.1533/9780857093844.3.427
[6] P.K. Bowen; W.H. Sillekens: Magnesium-based biodegradable implants, Jom. 68 (2016) 1175–1176, https://doi.org/https://doi.org/10.1007/s11837-016-1864-7
[7] Z. Yao; L. Li; Z. Jiang: Adjustment of the ratio of Ca/P in the ceramic coating on Mg alloy by plasma electrolytic oxidation, Appl. Surf. Sci. 255 (2009) 6724–6728, https://doi.org/10.1016/j.apsusc.2009.02.082
[8] O.I. Velikokhatnyi; P.N. Kumta: First-principles studies on alloying and simplified thermodynamic aqueous chemical stability of calcium-, zinc-, aluminum-, yttrium- and iron-doped magnesium alloys, Acta Biomater. 6 (2010) 1698–1704, https://doi.org/10.1016/j.actbio.2009.08.016
[9] J. Gonzalez; R.Q. Hou; E.P.S. Nidadavolu; R. Willumeit-Römer; F. Feyerabend: Magnesium degradation under physiological conditions – Best practice, Bioact. Mater. 3 (2018) 174–185, https://doi.org/10.1016/j.bioactmat.2018.01.003
[10] G. Amirhossein; R.A.K. Mohammed; R.A. Mohamed: Biodegradable Metals (Biodegradable Magnesium Alloys), in: Trauma Plat. Syst. Biomech. Mater. Biol. Clin. Asp., Elsevier, 2017: 143–158, https://doi.org/https://doi.org/10.1016/B978-0-12-804634-0.00008-2
[11] Nouha Loukil: Alloying Elements of Magnesium Alloys: A Literature Review, in: T.A. Tański, P. Jarka (Eds.), Magnes. Alloy., IntechOpen, 2021, https://doi.org/10.5772/intechopen.96232
[12] D.M. Vranceanu; I.C. Ionescu; E. Ungureanu; M.O. Cojocaru; A. Vladescu; C.M. Cotrut: Magnesium doped hydroxyapatite-based coatings obtained by pulsed galvanostatic electrochemical deposition with adjustable electrochemical behavior, Coatings. 10 (2020) 727–731, https://doi.org/10.3390/COATINGS10080727
[13] A.H.M. Sanchez; B.J.C. Luthringer; F. Feyerabend; R. Willumei: Mg and Mg alloys: How comparable are in vitro and in vivo corrosion rates? A review, Acta Biomater. 13 (2015) 16–31, https://doi.org/10.1016/j.actbio.2014.11.048
[14] J.F. Hernández-Sierra; F. Ruiz; D.C. Cruz Pena; F. Martínez-Gutiérrez; A.E. Martínez; A. de Jesús Pozos Guillén; H. Tapia-Pérez; G. Martínez Castañón: The antimicrobial sensitivity of Streptococcus mutans to nanoparticles of silver, zinc oxide, and gold, Nanomedicine Nanotechnology, Biol. Med. 4 (2008) 237–240, https://doi.org/10.1016/j.nano.2008.04.005
[15] U. Riaz; I. Shabib; W. Haider: The current trends of Mg alloys in biomedical applications – A review, J. Biomed. Mater. Res. - Part B Appl. Biomater. (2019), https://doi.org/10.1002/jbm.b.34290
[16] D. Wenwen; S. Yangshan; M. Xuegang; X. Feng; Z. Min; W. Dengyun: Microstructure and mechanical properties of Mg-Al based alloy with calcium and rare earth additions, Mater. Sci. Eng. A. 356 (2003) 1–7, https://doi.org/10.1016/S0921-5093(02)00551-8
[17] Y. Wan; G. Xiong; H. Luo; F. He; Y. Huang; X. Zhou: Preparation and characterization of a new biomedical magnesium-calcium alloy, Mater. Des. 29 (2008) 2034–2037, https://doi.org/10.1016/j.matdes.2008.04.017
[18] R.A. Surmenev: A review of plasma-assisted methods for calcium phosphate-based coatings fabrication, Surf. Coatings Technol. 206 (2012) 2035–2056, https://doi.org/10.1016/j.surfcoat.2011.11.002
[19] M.M. Almoudi; A.S. Hussein; M.I. Abu Hassan; N. Mohamad Zain: A systematic review on antibacterial activity of zinc against Streptococcus mutans, Saudi Dent. J. 30 (2018) 283–291, https://doi.org/10.1016/j.sdentj.2018.06.003
[20] D. Predoi; S.L. Iconaru; M.V. Predoi; M. Motelica-Heino; R. Guegan; N. Buton: Evaluation of antibacterial activity of zinc-doped hydroxyapatite colloids and dispersion stability using ultrasounds, Nanomaterials. 9 (2019) 515–521, https://doi.org/10.3390/nano9040515
[21] N. Ohtsu; Y. Kakuchi; T. Ohtsuki: Antibacterial effect of zinc oxide/hydroxyapatite coatings prepared by chemical solution deposition, Appl. Surf. Sci. 445 (2018) 596–600, https://doi.org/10.1016/j.apsusc.2017.09.101
[22] D.G. Tamay; S. Gokyer; J. Schmidt; A. Vladescu; P. Yilgor Huri; V. Hasirci; N. Hasirci: Corrosion Resistance and Cytocompatibility of Magnesium-Calcium Alloys Modified with Zinc- or Gallium-Doped Calcium Phosphate Coatings, ACS Appl. Mater. Interfaces. 14 (2022) 104–122, https://doi.org/10.1021/acsami.1c16307
[23] M.P. Seah; W.A. Dench: Quantitative electron spectroscopy of surfaces: a standard data base for electron inelastic mean free paths in solids, Surf. Interface Anal. 1 (1979) 2–11
[24] R. Akmene; A. Balodis; Y. Dekhtyar; G. Markelova; Y. Matvejevs; L. Rozenfeld; S. Sagalovich; Y. Smirnov; A. Tolkachov; A. Upminsh: Exoelectron emission spectrometre complete set of surface local investigation, Surfaces, Phys Chem Mech Surf. 8 (1993) 125–128
[25] ISO 16773-2: Electrochemical impedance spectroscopy (EIS) on coated and uncoated metallic specimens — Part 2: Collection of datap, 2016