Sich ändernde industrielle Anforderungen sind stets eine starke Triebkraft für Optimierungs- und Entwicklungsprozesse. Dies gilt auch für den eher traditionellen Bereich der elektrochemischen und galvanischen Oberflächenbehandlungen. In der Vergangenheit standen vor allem verbesserte Eigenschaften in Bezug auf Härte und Verschleißfestigkeit sowie Korrosionsbeständigkeit im Fokus.
Galvanische Schichten wurden in diese Richtung hin weiterentwickelt, gekennzeichnet insbesondere durch einen Übergang von einer Reinmetallabscheidung hin zur Legierungsabscheidung. Diese Systeme sind mittlerweile industriell etabliert und meist auch standardisiert. Ein erstes Umdenken gab es durch die rasch zunehmenden, umweltpolitisch motivierten, regulativen Änderungen, welche bewährte Systeme in ihrer Verwendung einschränkten und neben einer Verlagerung der Produktion in außereuropäische Drittländer auch zu einem Umdenken in der Verwendung gewisser Metalle und Badinhaltsstoffe führten.
Neue Anwendungen und Produktgenerationen machen zusätzliche Oberflächeneigenschaften erforderlich. Dazu zählen verbesserte chemische Stabilität, Bio-Kompatibilität, eine oberflächliche Mikrostruktur, Gleiteigenschaften (Thema selbstschmierende Oberflächen), magnetische Eigenschaften sowie laterale Wärme- oder Schockableitung. Galvanische Beschichtungen müssen ebenso wie anodische Passivierungen an diesen Bedarf angepasst werden. Zusätzlich stellen miniaturisierte Bauteile weitere Herausforderungen an die elektrochemische Bearbeitung. Erfordern solche Anforderungen und deren großindustrielle Realisierung schon ein gewisses Umdenken in der galvanischen Fertigung, so bedingen seit kurzem herstellbare Metallbauteile mit freien geometrischen Formen (z.B. bionische Bauteile) neue Oberflächenbearbeitungskonzepte.
Der Schlüssel zu der Ermöglichung solcher zusätzlichen Aufgaben ist neben der industriellen Nutzung der Dispersionsabscheidung und Schichtverbunden sowie einer Abscheidung komplexerer Legierungssysteme vor allem der Einsatz einer dynamischen Stromführung während des elektrochemischen Prozesses. Klassische thermodynamisch kontrollierte Prozesse (Gleichstromabscheidung, klassisches Anodisieren oder Elektropolieren) stoßen vermehrt an ihre Grenzen und müssen durch kinetisch kontrollierte, dynamische Verfahren ersetzt werden. All diesen Prozessen ist eine erhöhte Anforderung an die Strom- bzw. Potentialführung gemein, wodurch ein tieferes Verständnis der an der Oberfläche des Bauteiles ablaufenden elektrochemischen Prozesse zwingende Voraussetzung ist. Nur so lassen sich gepulste Prozesse genau auf das Bauteil und die Anforderungen an die Oberfläche einstellen.
Der prominenteste Vertreter der dynamischen elektrochemischen Verfahren ist sicherlich die Pulsabscheidung. Darüber hinaus gibt es jedoch noch einige andere interessante Verfahren welche im Rahmen dieses Kapitels vorgestellt werden sollen. Dazu zählen Pulsanodisierungen, gepulste Plasmaelektrolytische Oxidation (PEO), elektrochemisches Bearbeiten (ECM) und der kürzlich erst etablierte Prozess des Hirtisierens.
Pulse Plating
Unter Pulsabscheidung versteht man den Einsatz eines modulierten Stroms zur elektrolytischen Metallabscheidung. Am häufigsten werden durch geeignete Pulsgleichrichter Rechteckspulse, welche durch sog. Pulspausen unterbrochen sind, erzeugt. Ergänzt werden diese kathodischen Pulse (Metallabscheidung) durch einen oder mehrere, in regelmäßigen Abständen geschaltete anodische Strompulse (Metallauflösung). Eine sich ständig wiederholende Abfolge an kathodischen und anodischen Pulsen mit den entsprechenden Pulspausen (Auszeit) stellt die sogenannte Pulssequenz dar [1]. Die rasante Weiterentwicklung im Bereich der Computer- und Elektroniksysteme hat zu neuen Möglichkeiten geführt, Potentialfelder und Feldlinienverteilung in Abhängigkeit des angelegten Stroms zu visualisieren, die neuen Möglichkeiten in der Hochleistungselektronik erlauben nun die fehlerfreie Umsetzung schneller Pulse über geeignete Gleichrichtersteuerung. Dies ermöglichte die Entwicklung von Pulse Plating Prozessen aufbauend auf Effekten im Regime der sekundären Stromdichteverteilung (unter kinetischer Kontrolle) mit einer viel besseren Anwendungsmöglichkeit in der industriellen Produktion.
Durch Pulsabscheidung können mehrere Materialeigenschaften des abgeschiedenen Metalls gezielt verändert werden. Dahinter steht stets eine Variation der elektrochemischen Bedingungen über Einstellung der einzelnen Pulsparameter während der Abscheidung. Bei der Gleichstromabscheidung kann der Prozess lediglich über die Höhe des zur Abscheidung verwendeten Stroms (über die mittlere Stromdichte) variiert werden. Im Gegensatz dazu, steht dem Anwender bei der Puls- oder Umkehrpulsabscheidung ein beträchtlicher Satz an verschiedenen Parametern zur Prozessoptimierung zur Verfügung. Neben der mittleren Stromdichte sind das die kathodische und anodische Pulsstromdichte, die kathodische und anodische Pulsdauer, die Länge der Pulspause und die Pulsfrequenz. Abgeleitete Größen wie der Lastenzyklus (Verhältnis der Summe der Pulsdauern pro Sequenz zu der Summe der Länge der Pulspausen pro Sequenz) und das Verhältnis anodischer zu kathodischer Strommenge pro Sequenz sind weitere wichtige Einflussgrößen auf den Pulsabscheidungsprozess. Viele dieser Parameter können nicht völlig unabhängig von den anderen variiert werden, da sie sich teilweise gegenseitig beeinflussen. Diese Aufstellung berücksichtigt noch nicht die Möglichkeiten der komplexen Pulssequenzen. So hängt z.B. alleine die mittlere Stromdichte bei der Umkehrpulsabscheidung von der mittleren Stromdichte jav, der kathodischen Pulsstromdichte jkath, der anodischen Pulsstromdichte janod, der kathodischen Pulsdauer tkath, der anodischen Pulsdauer tanod und der Dauer der Pulspause toff ab.
Diese Fülle an relevanten Parametern macht einen rein empirischen Lösungsansatz fast unmöglich. Die genaue Kenntnis der elektrochemischen Grundlagen erlaubt allerdings eine wissensbasierte und damit deutlich effizientere Lösung dieser multidimensionalen Matrix. Insbesondere müssen die elektrochemische Kinetik bei der Pulsstromabscheidung, die notwendige Zeit für das Laden und Entladen der elektrolytischen Doppelschicht an der Elektrode (dem zu beschichtenden Werkstück), Stofftransportlimitierungen (Pulsgrenzstromdichte), Stromdichteverteilung und Kristallisationseffekte berücksichtigt werden. Numerische Simulationsprogramme zur Berechnung der elektrochemischen Verhältnisse in der Abscheidungswanne (z.B. Potentialfeld und Stromdichteverteilung) sind bei der Ermittlung der Parameter und somit bei der Optimierung der Pulsprozesse sehr hilfreich. Ein wesentlicher Schritt ist dabei das Verständnis der elektrochemischen Grundlagen des eingesetzten Elektrolytsystems. Aus diesem Grund wurde diesem Aspekt in allen Arbeiten stets eine besondere Bedeutung beigemessen. Untersuchungen an einer rotierenden Elektrode stellen hierfür den Kern der elektrochemischen Arbeiten dar.
Die maximale Pulsfrequenz beeinflusst die Struktur und die Eigenschaften der abgeschiedenen Metallschicht. Insbesondere durch die zunehmende Aktualität der Nanotechnologie trachteten verschiedene Forschungsgruppen nach einem möglichst feinkristallinen Metallniederschlag mit Primärkristallitgrößen im Nanometerbereich. Die oft publizierten extrem kurzen Pulszeiten lieferten im Labormaßstab unter der genauen Einhaltung komplexer Versuchsbedingungen auch tatsächlich „nanokristalline“ Metallschichten. In der Praxis bestimmt jedoch die für die Aufladung (und Entladung) der elektrolytischen Doppelschicht notwendige Zeit die maximale Pulsfrequenz (und somit die minimal mögliche Pulsdauer). Wird diese Grenzzeit unterschritten kommt es zu deutlichen Verzerrungen der angelegten Rechteckspulse an der Elektrodenoberfläche (dem zu beschichtenden Werkstück). Die Pulsabscheidung würde dadurch unkontrollierbar und schwer reproduzierbar werden. Aus diesem Grund müssen der Prozess und die Pulssequenz so definiert werden, dass die Zeit, in der die Auf- und Entladung der Doppelschicht erfolgt, viel kürzer als die Pulsdauer bzw. die Pause nach dem Puls ist. Eine Bestimmung der Auflade- und Entladezeiten muss für jedes Elektrolytsystem gesondert durchgeführt werden.
Die Limitierung durch den Stofftransport beruht auf der Verarmung der Kationen in der Diffusionsschicht an der Elektroden-(Werkstück)oberfläche. Die Pulsabscheidung kann direkt den Aufbau und die Dicke der Diffusionsschichten beeinflussen. So kann bei der Pulsstromabscheidung zwischen zwei verschiedenen Diffusionsschichten unterschieden werden. In unmittelbarer Nähe der Kathode schwankt die Metallionenkonzentration im Rhythmus der Pulsfrequenz, man spricht von einer pulsierenden Diffusionsschicht. An diese anschließend in Richtung Lösungsinnere folgt eine weitere Diffusionsschicht mit einem konstanten Konzentrationsgefälle (stationäre Diffusionsschicht). Die Verarmung der Kationen in der pulsierenden Diffusionsschicht begrenzt die Pulsstromdichte, die Verarmung in der äußeren Diffusionsschicht begrenzt die mittlere Stromdichte. Die praktische Stromdichte kann im Vergleich zu Gleichstrom somit leicht erhöht werden, eine weitere Erhöhung der mittleren Stromdichten gelingt nur bei Manipulation der Stromdichteverteilung bei der Umkehrpulsabscheidung.
Pulsstromabscheidung erlaubt auch die gezielte Modifikation der Niederschlagseigenschaften, welche von der abgeschiedenen Mikrostruktur abhängen. Die Niederschlagsstruktur wird einerseits von der Bildung der Pirmär- kristallite des abgeschiedenen Metalls und andererseits vom Weiterwachsen dieser Kristallite bestimmt. Das Verhältnis von Kristallitbildung und Kristallwachstum kann durch die Pulsabscheidung (z.B. über die Pulsstromdichte, die Pulsfrequenz oder den Lastenzyklus) beeinflusst werden. Auch die generelle Schichtstruktur (kolumnar/feinkristallin/lamellar) kann bei der Pulsabscheidung verändert werden. Hier spielt auch der anodische Anteil in der Pulssequenz eine wesentliche Rolle. Bei Veränderung des anliegenden Stroms durch Pulse kann sich die Art der adsorbierten Spezies ändern, und je nach Geschwindigkeitskonstante der Adsorption verändert sich dadurch die Oberflächendiffusion. Dies führt zu verschiedenen Kristallisationsmechanismen und Eigenschaften des abgeschiedenen Niederschlages.
Die Kinetik gleichzeitig ablaufender Reaktionen hat einen großen Einfluss auf die relative Geschwindigkeit konkurrierender Reaktionen, z.B. bei der Legierungsabscheidung oder Wasserstoffentwicklung [1]. Durch Beeinflussung der Abscheidungskinetik über die Form und Folge der angelegten Strompulse können Legierungszusammensetzungen und -phasen manipuliert und Nebenreaktionen unterdrückt werden. Bei der Reduktion des entstehenden Wasserstoffs spielt auch die Pulspause eine wichtige Rolle. Während der Strompausen können adsorbierte Stoffe oder Gasbläschen desorbieren, insbesondere bei gleichzeitig guter Badbewegung.
Die klassische und wohl am besten beschriebene Anwendung der Pulsabscheidung ist die Leiterplattenfertigung. Das System Kupfer gilt als Modellsubstanz. Durch die enormen Wachstumszahlen in den letzten zwei Jahrzehnten (Asien!) hat auch die Chemieindustrie einen nicht unbeträchtlichen Beitrag zur Optimierung dieses Systems durch Optimierung der Elektrolyte geleistet. Vollautomatische Produktionsstraßen mit exakter Badführung und genau definierten (horizontalen) Galvanikzellen stellten lange Zeit die Spitze der Pulsabscheidung dar.
Im Windschatten dieser Entwicklung gab es immer wieder Versuche, die Pulsabscheidung auch auf anderen Gebieten einzusetzen. Seit etwa 20 Jahren wird vor allem bei der Edelmetallabscheidung gerne auf die Möglichkeiten der Pulsabscheidung zurückgegriffen. Triebkraft war hier stets die Materialeinsparung bei meist verbesserten Schichteigenschaften. So ist es über Anwendung der Umkehrpulsabscheidung sehr gut möglich, die Mindestschichtdicken von Kontakt- und Schutzschichten aus Gold deutlich zu reduzieren. Dies gelingt nicht nur im Gestell sondern insbesondere im Bandverfahren sehr gut.
Eine oft in der breiteren Öffentlichkeit unbemerkt gebliebene Anwendung der Pulsabscheidung ist die Herstellung von Festplatten. Über genau definierte Pulsabscheidungsverfahren werden magnetische Multilagenschichten erzeugt, die dann als eigentliche Träger der gespeicherten Information fungieren.
Durch die sich sehr rasch ändernden Rohstoffpreise, insbesondere gültig für Nickel, beginnt sich die Pulsabscheidung auch in anderen Bereichen mehr und mehr durchzusetzen. So gibt es bei einzelnen Verfahren zur Kupfer- abscheidung und bei der funktionellen Vernickelung industrielle Anwendungen zur Erhöhung der Schichtgleichmäßigkeit und damit zur Einsparung von Rohstoffen. Auch eine Erhöhung der Produktionskapazität bei gleichbleibenden Schichteigenschaften ist eine mögliche Anwendung und ist selbst bei den im Moment wieder deutlich niedrigeren Rohstoffpreisen eine wesentliche Triebkraft zur Umstellung auf Pulsabscheidung.
Tribologisch aktive Schichten lassen sich über Pulsabscheidung von Legierungen erzielen. Dieser Effekt kann durch den Einbau von Mikro- oder Nanopartikeln weiter verstärkt werden. Neben klassischen Anwendungen wie dem Einbau von Makropartikeln in Schleifwerkzeugen und Mikro- bis Nanopartikeln in verschleißfesten Oberflächenbeschichtungen stehen aktive Partikel vermehrt im Vordergrund. Dies kann die Herstellung einer katalytisch aktiven Oberfläche sein, oder der Einbau von Wirkstoffen im Bereich antiseptischer/antibakterieller Oberflächen. Alle in diesen Arbeiten durchgeführten Untersuchungen zur Kombination der elektrochemischen Pulsabscheidung mit dem Einbau unterschiedlicher Partikelklassen basieren auf der Aufklärung und Einstellung des Zetapotentials der inerten Partikel im Elektrolyten.
Besonders interessant erscheint die Anwendung der Pulsabscheidung auch im Bereich der Bandgalvanik, wo z.B. eine erhöhte Gleichmäßigkeit (verbesserte Schichtdickenverteilung) der abgeschiedenen Schichten bei den in diesem Bereich (Mikrokontakte und ähnliches) oft eingesetzten Edelmetallen sofort zu einem deutlichen Einsparungspotential führt. Hier kann durch die exakt fixierbaren Zellgeometrien auch der Vorteil der numerischen Prozesssimulation besonders gut eingesetzt werden.
Hartchromschichten sind wohl der prominenteste Vertreter solcher tribologisch relevanten galvanischen Oberflächen. Rissfreie Hartchromschichten können über Pulsverfahren ebenso hergestellt werden wie mikrostrukturierte Oberflächen. Gerade in Bezug auf Ersatzschichten zur Hartverchromung führen alle gängigen, chromfreien Alternativen über Legierungsschichten. Einige dieser Legierungen sind über Gleichstromabscheidung nicht oder nicht sinnvoll darstellbar, hier hat die Pulsabscheidung eine ganz zentrale Rolle. Durch geeignete Steuerung der Legierungszusammensetzung und Erhöhung der Härte über gezielte strukturelle Veränderung in der Schicht durch geeignete Wahl der Pulsbedingungen können heute leistungsfähige, an eine Hartverchromung heranreichende Systeme industriell eingesetzt werden.
Der strukturelle Einfluss wirkt sich auch auf die Duktilität der Schichten aus, gerade im Bereich der Mikrogalvanik und bei Mikrokontakten eine entscheidende Schichteigenschaft. Sehr dichte Strukturen eignen sich ausgezeichnet als Barriereschichten.
Generell ist Pulsabscheidung dort am erfolgreichsten, wo eine besondere Funktionalität der galvanischen Schichten im Vordergrund steht. Magnetische Schichten sind nicht nur für Speichermedien essentiell, sondern öffnen über die Möglichkeiten nichtmagnetische Werkstücke oberflächlich zu magnetisieren ein sehr breites Anwendungsspektrum. Sowohl weich- als auch hartmagnetische Systeme können hergestellt werden und liefern die Basis für unterschiedlichste Sensorik- und Steuerungsanwendungen. Über Gleichstrom nur schwer erhältliche Legierungssysteme können ebenfalls über Pulsabscheidung dargestellt werden.
Allgemein ist zu erwarten, dass kurz- und mittelfristig weitere Anwendungen mittels Pulsabscheidungen realisiert werden. Ein Ersatz von Gleichstromschichten durch gepulst hergestellte Metallüberzüge ist in vielen Bereichen langfristig wahrscheinlich.
Pulselektropolieren
Elektropolieren ist eine elektrochemische Methode zur Nachbearbeitung von Metallen bei der mittels anodischer Auflösung die Oberflächenrauigkeiten reduziert und die Oberflächen geglättet werden. Auf diese Weise sind verschiedene Metalle und Legierungen nachbearbeitbar, wobei auch andere Materialien wie Silizium erfolgreich elektropoliert werden können. In der Regel erfolgt Elektropolieren in unbewegten Elektrolyten auf Basis von Phosphor-, Schwefel-, Perchlor- oder Essigsäure. Als Lösungsmittel dient in solchen Elektrolyten meist Wasser (in geringen Konzentrationen) oder auch Alkohole wie Methanol. Neuere Entwicklungen zeigen auch eine hohe Leistungsfähigkeit von Salzschmelzen oder ionischen Flüssigkeiten als Medien zum Elektropolieren [1].
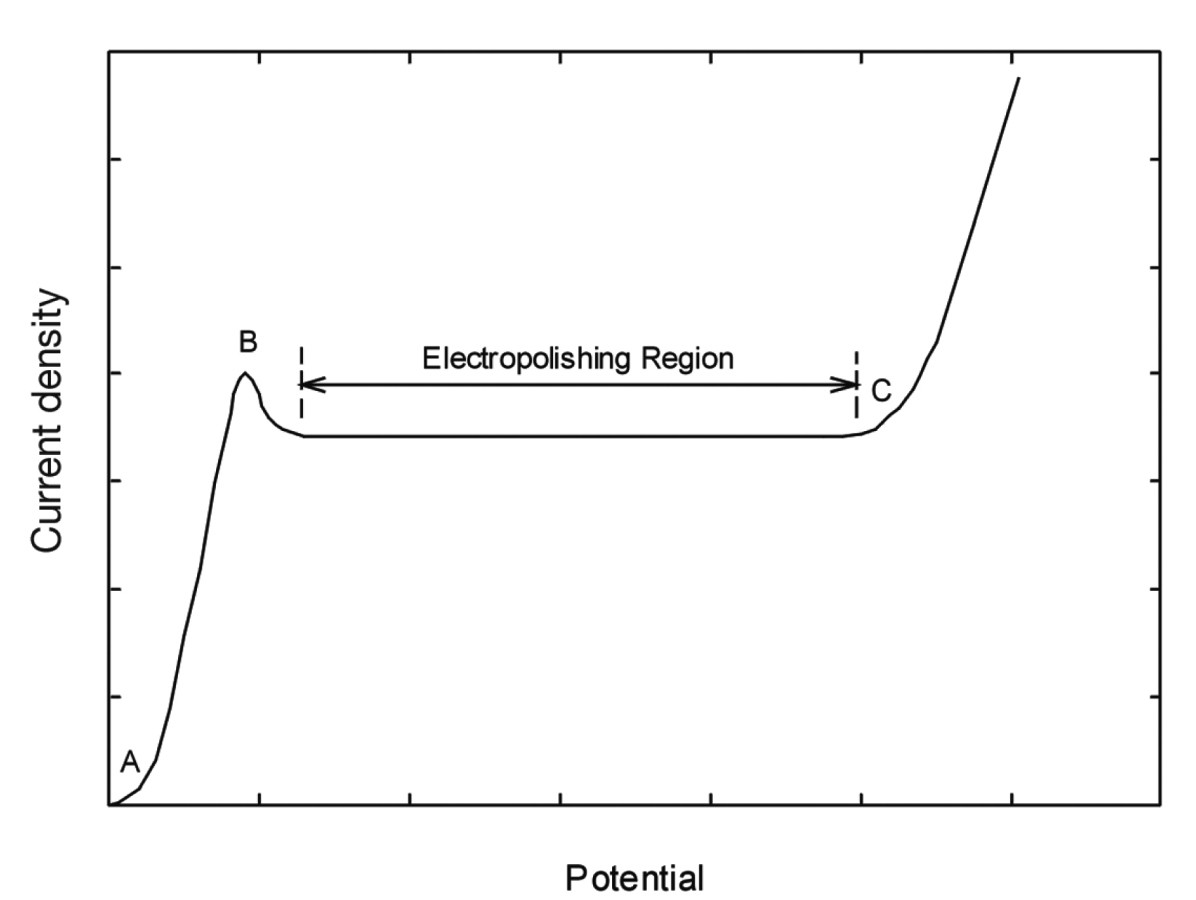 Abb. 1.: Schematische Darstellung der anodischen Polarisationskurve für einen typischen Elektropolierelektrolyten. Der Kurvenabschnitt A-B entspricht dem Bereich der aktiven Auflösung, der Bereich B-C ist die Region der anodischen Filmbildung. In diesem Bereich liegen Grenzstrombedingungen vor, erkennbar am sich ausbildenden Stromplateau
Abb. 1.: Schematische Darstellung der anodischen Polarisationskurve für einen typischen Elektropolierelektrolyten. Der Kurvenabschnitt A-B entspricht dem Bereich der aktiven Auflösung, der Bereich B-C ist die Region der anodischen Filmbildung. In diesem Bereich liegen Grenzstrombedingungen vor, erkennbar am sich ausbildenden Stromplateau
Die typische schematische Darstellung einer anodischen Polarisationskurve für ein elektrochemisches System ist Abbildung 1 zu entnehmen. Der Kurvenabschnitt A-B entspricht dem Bereich der aktiven Auflösung, der Bereich B-C ist die Region der anodischen Filmbildung. In diesem Bereich liegen Grenzstrombedingungen vor, erkennbar am sich ausbildenden Stromplateau. Innerhalb der aktiven Region findet Auflösung bevorzugt an gewissen Kristallflächen und Defekten statt, was zu matten und mitunter auch rauen Oberflächen führen kann. Das sich ausbildende Stromplateau steht mit der Bildung eines Oberflächenfilms in Zusammenhang. Zentraler Effekt solcher Filme ist die Minimierung kristallographischer Ätzeinflüsse. Diese Region stellt den effektivsten Bereich für das Elektropolieren dar. In diesem Bereich herrscht tertiäre Stromdichteverteilung vor, der Prozess steht unter Diffusionskontrolle.
Der exakte Aufbau dieses Passivfilms ist noch nicht restlos aufgeklärt, es existieren mehrere Modelle unterschiedlich viskosen oder kompakten Oberflächenfilms [1]. Neueste Theorien postulieren die Existenz eines Salzfilmes da im Bereich des Stromplateaus Massentransportkontrolle vorliegt [2]. Ein Poliereffekt wird allerdings auch unter transpassiven Bedingungen berichtet [3].
Beim Elektropolieren wird grundsätzlich zwischen Oberflächeneinebnung und Glänzen unterschieden. Ersteres bezieht sich auf die Entfernung gröberer Rauigkeiten (> 1 μm) während letzteres auf die Minimierung von Unebenheiten wesentlich geringerer Größe (< 1 μm) zielt. Zur Herstellung spiegelnder Oberflächen ist das Eliminieren von Oberflächenunebenheiten mit einer vergleichbaren Wellenlänge zu sichtbarem Licht (λ < 1 μm) vonnöten. Die meisten industriell relevanten Anwendungen von Elektropolierprozessen benötigen die Kombination dieser beiden Funktionen, wobei die Mechanismen beider Prozesse (Einebnen-Glänzen) sich grundsätzlich voneinander unterscheiden. Zum Glänzen ist lediglich die Ausbildung des Oberflächenfilms zur homogenen anodischen Auflösung vonnöten, wobei für die geeignete Einebnung hauptsächlich die vorherrschende Stromdichteverteilung verantwortlich ist [1].
Die Anwendung gepulster elektrochemischer Methoden basiert auf denselben Grundlagen des Elektropolierens. Bei gleicher mittlerer Stromdichte tendiert die Stromdichteverteilung bei der Pulselektropolitur zu einem stärker primären Verhalten. Somit ist der geometrieabhängige Einebnungseffekt gegenüber der klassischen gleichstromkontrollierten Politur verstärkt. Unter rein tertiären Stromdichtebedingungen hängt der einebnende Effekt vor allem von der Dicke der Diffusionsschicht ab (δ und δp). Über die geeignete Wahl der Pulsparameter kann diese Schichtdicke gezielt variiert werden. So ist es möglich, ein sogenanntes Mikroprofil in ein Makroprofil umzuwandeln. Dies ist bei der Pulsabscheidung von Vorteil, führt jedoch beim Pulselektropolieren zu defacto keinerlei Makro-Einebnung. Unter diesen Bedingungen kann jedoch ein Hochglanz auf den Oberflächen erzeugt werden. Beim Pulselektropolieren muss also bewusst ein für die Abscheidung eher nachteiliger Zustand hergestellt werden. Die gezielte Einstellung von Massentransportkontrolle ist mittels gepulsten Strömen (oder Potentialen) gut möglich. Die Auszeit (Off-Time) kann ebenfalls eine bestimmte Rolle spielen, gleichsam der Pulsabscheidung werden in der Auszeit Reaktionsprodukte von der Oberfläche abtransportiert. Zu lange Auszeiten führen jedoch zur Auflösung des während der Strompulse erzeugten anodischen Polierfilms. In diesem Fall käme es zu chemischem Ätzen und einer damit verbundenen Aufrauhung der Oberfläche [4].
Trotz dieser unterschiedlichen Möglichkeiten zur genauen Einstellung der elektrochemischen Polierbedingungen wird Pulselektropolieren industriell kaum bzw. nur in Nischen eingesetzt [5, 6]. Dies mag an der Herausforderung der genauen Einstellung der einzelnen Parameter liegen, welche eine wissensbasierte Herangehensweise bedingt. In einem industriellen Umfeld wird dadurch meist der einfachere Gleichstromprozess bevorzugt. Die wichtigsten Einsatzgebiete des Pulselektropolieren sind unterschiedliche Formen des Edelstahls, allen voran für medizintechnische Anwendungen [7, 8]. Eine Anwendung ist auch das mechanisch unterstützte Polieren (elektrochemisches Wischpolieren). Hier muss über angepasste Pulsführung der Zustand der tertiären Stromdichteverteilung zwischen den zyklischen Bearbeitungsschritten eingestellt werden. Durch die mechanische Bearbeitung wird der Polierfilm kurz zerstört und wird danach durch Strompulse wiederaufgebaut. Ergebnis dieses kombinierten Verfahrens sind hochglänzende, glatte Oberflächen.
In der Medizintechnik wird Pulselektropolieren dazu benutzt, um die Oberflächen miniaturisierter Implantate wie zum Beispiel Stents aus Edelstahl zu glätten. Im Vergleich zu Gleichstromverfahren sind aus schwefel- und phosphorsauren Elektrolyten wesentlich geringere Oberflächenrauigkeiten erreichbar [7, 8]. Interessanterweise sind dabei relativ geringe Pulsfrequenzen (50Hz) effektiver als hochfrequente Pulse (>1kHz). Bei hohen Pulsfrequenzen reicht die Pulsdauer nicht zur Bildung eines homogenen Oberflächenfilms aus. Ein weiterer Vorteil besonders an feinen Mikrostrukturen ist das Absprengen sich bildender Gasblasen durch die Strompulse.
Auch Edelmetalle wie Niob werden über gepulste Verfahren elektropoliert, insbesondere zur Herstellung supraleitender Oberflächen für die Radiofrequenzleitung (SRF) in Hochenergie-Teilchenbeschleunigern [9].
Da Elektropolieren nicht nur zur Verbesserung des dekorativen Aussehens, sondern zunehmend zur Verbesserung der Korrosionsbeständigkeit und der Abriebbeständigkeit, industriell eingesetzt wird, steigt die Zahl der Applikationen allgemein. Mit besseren Kenntnissen der elektrochemischen Grundlagen und getrieben von immer höheren Anforderungen an die Bauteiloberflächen ist deswegen zu erwarten, dass neben klassischem Gleichstrompolieren auch das Pulselektropolieren an Bedeutung gewinnen wird.
Pulsanodisierung
Viele Metalle bilden unter anodischen Potentialbedingungen einen passiven Oberflächenfilm aus. Dieser ist meist dünn (wenige Nanometer) und wirkt einer weiteren Metallauflösung entgegen. Einige Metalle wie Titan, Aluminium, Zirkon, Tantal zeigen ein etwas anderes Verhalten (siehe Abb. 2). Bei diesen Metallen bildet sich unter Luftsauerstoff nicht nur eine (dünne) natürliche Oxidschicht aus, es lässt sich zusätzlich die Dicke des anodischen Films über Anlegung von Strom oder einem anodischen Potential bis in den Mikrometermaßstab weiter vergrößern [10]. Dieser Prozess wird Anodisierung genannt. Die resultierenden Schichten haben eine niedrige elektrische Leitfähigkeit und schirmen auch transpassive Reaktionen bis hin zu höheren Potentialen ab. Solche dicken Oxidfilme fungieren als Korrosions- und Verschleißschutz. Über Farbstoffeinlagerung können bunte, dekorative Schichten hergestellt werden.
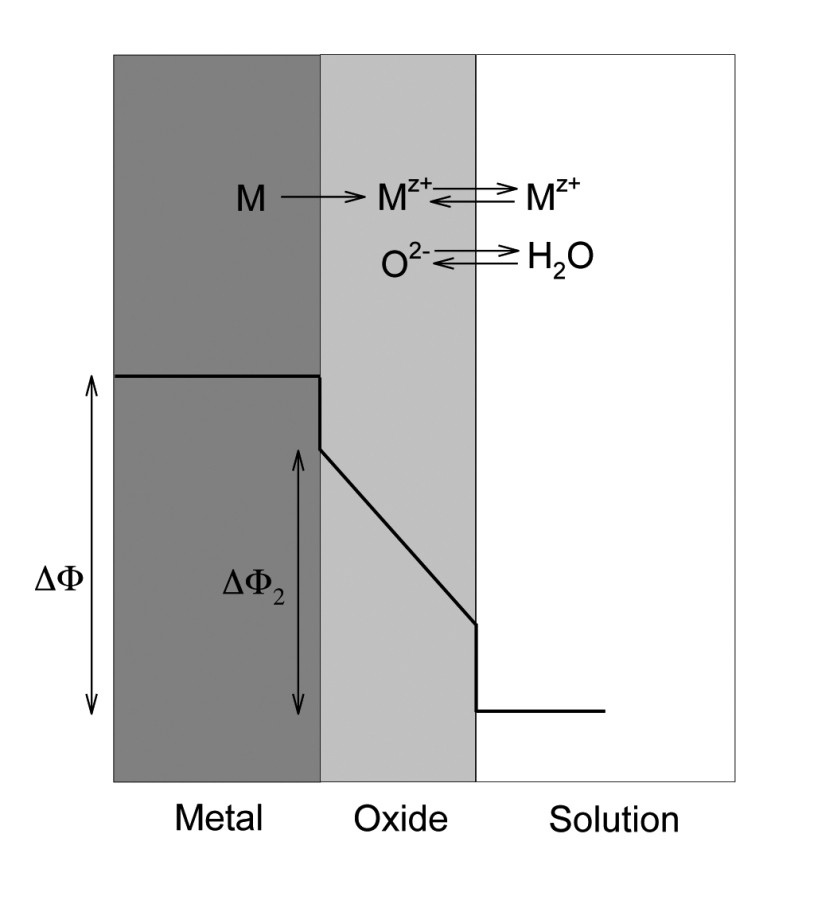 Abb. 2.: Schematische Darstellung der bei der Anodisierung einer Metalloberfläche des Metalls M ablaufenden Prozesse mit der zugehörigen Variation des Potentials über den Querschnitt
Abb. 2.: Schematische Darstellung der bei der Anodisierung einer Metalloberfläche des Metalls M ablaufenden Prozesse mit der zugehörigen Variation des Potentials über den Querschnitt
Die wichtigsten industriell genutzten Anodisierungen betreffen die Metalle Aluminium, Titan und Tantal sowie deren Legierungen. Aluminium und Tantal werden in ihrer anodisierten Form für Kondensatoren verwendet, Aluminium für unterschiedliche Dinge des täglichen Bedarfs (von der Trinkflasche bis hin zur Hausfassade) und Titan meist für medizintechnische Produkte und Implantate [11–13].
Die Anwendung von gepulsten Strömen (Potentialen) bei der Anodisierung greift direkt in den Aufbaumechanismus der Schichten ein. Das Schichtwachstum beinhaltet eine Reihe an Ionentransferreaktionen an der Grenzschicht zwischen dem Metall und der Oxidschicht und der Oxidschicht und dem Elektrolyten [14]. Abbildung 2 zeigt schematisch diese Reaktionen in Korrelation mit dem Potentialverlauf.
Das bekannteste mechanistische Modell ist das so genannte „high field conduction“ Modell welches die Wachstumsgeschwindigkeit des Oxidfilms in Korrelation zu der Bewegung der Kationen im angelegten elektrischen Feld setzt. Unter rein potentiostatischen Bedingungen (also konstantem Potential) reduziert sich mit wachsender Oxidfilmschichtdicke das Potentialfeld und die Reaktion verlangsamt sich mit einem exponentiell abnehmenden Stromfluss. Ab einem gewissen Zeitpunkt ist der Stromfluss bis auf ein vernachlässigbares Niveau reduziert und es findet defacto kein Schichtwachstum mehr statt. Unter konstantem Strom (galvanostatische Bedingungen) steigen mit fortschreitender Dauer der Anodisierung sowohl die Schichtdicke als auch das Potential linear an.
Der wichtigste Anodisierungsprozess betrifft Aluminium und seine Legierungen und wird unter Wechsel-, Gleich- und Pulsstrombedingungen durchgeführt. In neutralen Lösungen können auf diese Weise Barriereschichten hergestellt werden, welche üblicherweise in der Herstellung von Kondensatoren zur Anwendung kommen. In sauren sowie basischen Medien können dickere Oxidschichten erzeugt werden (Abb. 3). Zu Beginn der Anodisierung entsteht zunächst eine dünne, sehr kompakte Schicht mit einer Dicke von 20–100 nm. Mit fortschreitender Anodisierung und wachsender Schicht wird der Oxidfilm zunehmend poröser. Dieser poröse Film kann eine Dicke von bis zu einigen Dutzend Mikrometern erreichen. Die entstandene Schicht besteht aus einem System aus im Wesentlichen parallel ausgerichteten Poren, welche bis zu der initialen dünnen Barriereschicht reichen. Jede Pore und das sie umgebende Material bilden eine hexagonale Zelle, welche zu einer engen, wabenförmigen Gitterstruktur geschlichtet sind. Die Porendurchmesser liegen dabei im Bereich von 10–30 nm [15] und stehen in einem direkten Zusammenhang mit dem angelegten Potential.
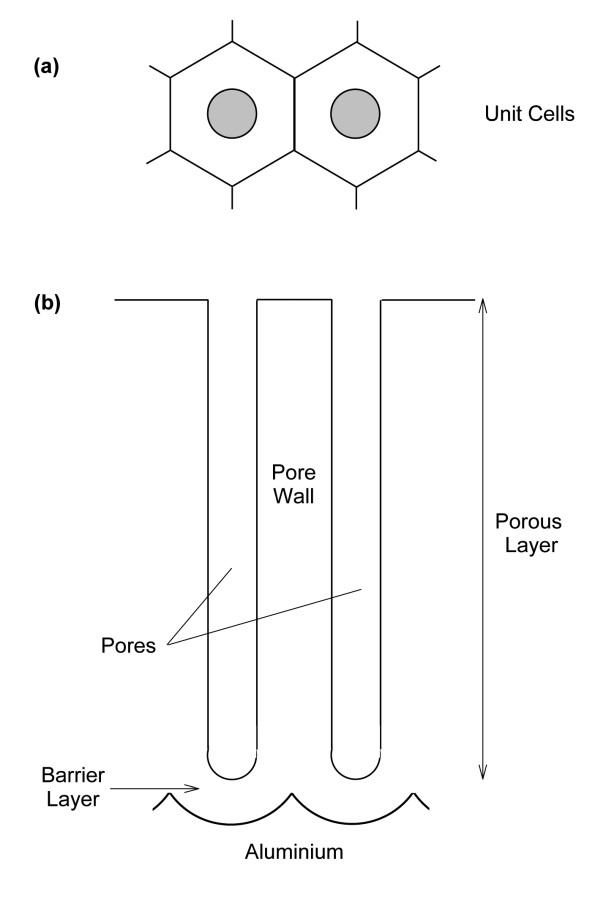 Abb. 3.: Idealisierte Struktur eines porösen Oxidfilms bei der Anodisierung: (a) Vogelperspektive mit der hexagonalen Wabenstruktur, (b) Querschnitt
Abb. 3.: Idealisierte Struktur eines porösen Oxidfilms bei der Anodisierung: (a) Vogelperspektive mit der hexagonalen Wabenstruktur, (b) Querschnitt
Nach der Anodisierung können die Schichten auf unterschiedliche Arten eingefärbt werden, als Beispiele seien die Einlagerung von Farbpartikeln oder die Ausfällung von Metallsalzen in die poröse Struktur genannt. Im Anschluss werden die Schichten über Umwandlung des Alumiumoxids in Böhmit durch Kochen in heißem Wasser versiegelt. Die bei der Reaktion entstehende Volumensvergrößerung verschließt die Poren und erhöht so die Korrosionsbeständigkeit. Es bestehen parallel dazu auch chemische Versiegelungsmethoden [15]. Im Bereich der Mikro- und Nanotechnologie wird oftmals die offene Porenstruktur bevorzugt, hier wird auf die Versiegelung verzichtet.
Trotz der langen Historie der Anodisierung gibt es immer noch bestehende Probleme, allen voran das sog. „Anbrennen“ sowie pulvrige Niederschläge [16, 17]. Das Phänomen des „Anbrennens“ entsteht durch ein ungleichmäßiges Wachstum der Bariereschicht und die Ausbildung von nadelförmigem Aluminium. Diese Nadeln reichen durch die gebildete Oxidschicht hindurch und verursachen so lokal sehr hohe Stromdichten bei der Anodisierung. Damit verbunden ist ein lokal sehr starker Temperaturanstieg. Pulvrige Schichten entstehen durch chemische Auflösung der Porenwände bei zu langen Anodisierungszeiten. Dadurch entstehen größere Porendurchmesser, vor allem an der Mündung der Poren, welche schließlich zu Wanddurchbrüchen führen. Die Poren beginnen ineinander zu wachsen was in einem pulvrigen, weicheren Niederschlag resultiert. Die Verhinderung des Anbrennens und der pulvrigen Niederschläge bedürfen mitunter genau entgegengesetzte Maßnahmen. Hier stehen Gleichstromprozesse bald an ihren Grenzen [17].
Das entscheidende Phänomen hinter der Pulsanodisierung ist der sogenannte Erholungseffekt (Recovery Effect, siehe Abb. 4) [18, 19].
Die Anodisierung findet zu Beginn bei dem Potential E1 über eine gewisse Zeit (a bis b in Abb. 4) statt. Nach dieser Zeit (b bis c) bildet sich ein Gleichgewichtsstrom aus. Der bei dem Potential E1 entstehende Film weist einen großen Porendurchmesser auf und die zugrundeliegende Barriereschicht ist dick. Wird das Potential rasch auf E2 abgesenkt, fällt auch der fließende Strom stark ab (d bis e), um danach wieder langsam bis zu einem konstanten Wert ansteigt (f bis g). Bei Erreichen des niedrigeren Potentials E2 kommt das Schichtwachstum fast zum Stillstand. Die Dicke der Barriereschicht nimmt in Folge durch chemische Auflösung ab. An einem gewissen Punkt wird die Barriereschicht so dünn, dass sich das elektrische Feld zu erholen beginnt und weiteres Filmwachstum ermöglicht. Die bei Potential E2 entstehenden Poren haben einen wesentlich kleineren Durchmesser als unter den Potentialbedingungen E1. Wiederholung dieser Pulssequenz führt zu einer Struktur aus alternierenden Lagen mit kleinen und großen Porendurchmessern [13].
![Abb. 4: Der während der Pulsanodisierung beobachtbare Erholungseffekt zwischen dem höheren Potential (E1) und dem niedrigeren Potential (E2). Die Erholungszeit wird dabei mit τrec. angegeben [20] Abb. 4: Der während der Pulsanodisierung beobachtbare Erholungseffekt zwischen dem höheren Potential (E1) und dem niedrigeren Potential (E2). Die Erholungszeit wird dabei mit τrec. angegeben [20]](/images/stories/Abo-2022-05/gt-2022-05-0028.jpg) Abb. 4: Der während der Pulsanodisierung beobachtbare Erholungseffekt zwischen dem höheren Potential (E1) und dem niedrigeren Potential (E2). Die Erholungszeit wird dabei mit τrec. angegeben [20]
Abb. 4: Der während der Pulsanodisierung beobachtbare Erholungseffekt zwischen dem höheren Potential (E1) und dem niedrigeren Potential (E2). Die Erholungszeit wird dabei mit τrec. angegeben [20]
Das Potential E1 entspricht also einem raschen Schichtwachstum und der Ausbildung harter Oxidschichten. Gleichstromanodisierung bei diesem Potential führt über einem gewissen Zeitraum zu „angebrannten“ Schichten, was durch Umschalten auf ein niedrigeres Potential vermieden werden kann. Der Puls mit dem niedrigeren Potential sorgt wie vorhin beschrieben für die Dünnung der Barriereschicht sowie für deren gleichmäßigere Ausbildung [20, 21]. Dadurch wird die Gefahr der Ausbildung von nadelförmigen Niederschlägen minimiert und die Stromverteilung über die einzelnen Poren verbessert. Zusätzlich wird das Thermomanagement in der Schicht verbessert, da die entstehende Reaktionswärme ausreichend Zeit zur Ableitung hat und die Temperaturverteilung über das Bauteil deutlich gleichmäßiger ist. Dadurch wird das Anbrennen der Schichten vermieden. Die über Strompulse hergestellten Schichten sind somit, härter, gleichmäßiger und zeigen defacto keine Tendenz zum Anbrennen oder für pulvrige Niederschläge. Die bei der Pulsanodisierung verwendeten Frequenzen sind von der Größenordnung her deutlich über den bei der Pulsabscheidung zum Einsatz kommenden und liegen in der Regel im Bereich mehrerer Sekunden. Praxisberichte zeigen eine verbesserte Versiegelung sowie bessere Korrosionswiderstände solcher Oxidschichten auf Aluminiumlegierungen [22, 23].
Pulsanodisierung kommt industriell zur Oberflächenbehandlung von Aluminium (-legierungen) und Tantal für die Herstellung elektrischer Kondensatoren zum Einsatz. Auch beim Hartanodisieren hat es sich vielfach als vorteilhaft erwiesen. Während in klassischen Bereichen wie Eloxieren meist Gleichstrom oder Wechselstrom bei der Anodisierung zum Einsatz kommen, ist die Pulsanodisierung bei der Herstellung von Mikrosystemen oder nanoskaligen Templates gut etabliert. Bei der Herstellung von Nanostrukturen (Nanodrähte bzw. Nanowires sowie metallischer Nanotubes) sind Pulsprozesse zur Herstellung der notwendigen Templates mit homogener Porenstruktur unerlässlich [11–13]. Die Porenstruktur bei der Gleichstromanodisierung ist von der Verteilung der Durchmesser über die Oberfläche viel zu ungleichmäßig um sie zur reproduzierbaren Produktion solcher Nanobauteile verwenden zu können. Zusätzlich neigen Gleichstromanodisierungen zur Ausbildung von Verzweigungen und Defekten. Pulsanodisierung führt nicht nur zu einer sehr gleichmäßigen und weitgehend defektfreien Porenverteilung, sondern ermöglicht auch über die Wahl der Pulsbedingungen (Potentiale) die gezielte Einstellung der Porengeometrie.
Pulsed Plasma Electrolytic Oxidation (PEO)
Plasmaelektrolytische Oxidation (Abb. 5) ist ein leistungsfähiger Prozess für die Behandlung von Leichtmetalloberflächen und besonders geeignet zur Oberflächenbehandlung industriell relevanter Leichtmetallegierungen, insbesondere der Legierungen von Aluminium, Magnesium und Titan. [24–26] Zu Prozessbeginn wird durch anodische Oxidation eine passive Oberfläche generiert. Durch das nachfolgende Anlegen höherer Potentiale kommt es zur Ausbildung von elektrischen Mikroentladungen zwischen Substrat (Werkstück) und dem verwendeten Elektrolyten. Am Ausgangspunkt des Bogens kommt es zur Reaktion zwischen Substrat und Elektrolyt, was in diesem Bereich zur lokalen Aufschmelzung des Substrats, dem Einbau von Elektrolytbestandteilen und zur Ausbildung einer keramischen Schicht führt. Die so entstandene Schicht ist wesentlich stärker isolierend als die zu Beginn generierte Passivschicht an der Werkstückoberfläche, was dazu führt, dass die Ausbildung des nächsten Bogens an einer anderen Stelle erfolgt. Dieser Vorgang wiederholt sich bis die gesamte Werkstückoberfläche vollständig mit der keramischen Schicht überzogen wurde. Der größte Vorteil der PEO Schichten liegt in der hohen Schichthärte und damit gekoppelt einer guten Abriebfestigkeit. Ein vollständiger Oberflächenüberzug bietet mitunter auch einen Schutz des Werkstückmaterials gegenüber chemischem Angriff wie z. B. durch ätzende Medien.
![Abb. 5: Die einzelnen Schritte eines PEO Prozesses [24] Abb. 5: Die einzelnen Schritte eines PEO Prozesses [24]](/images/stories/Abo-2022-05/gt-2022-05-0029.jpg) Abb. 5: Die einzelnen Schritte eines PEO Prozesses [24]
Abb. 5: Die einzelnen Schritte eines PEO Prozesses [24]
Ist der Vorgang der Umwandlung zur Oxidschicht jedoch unzureichend, so kann es zur Bildung von Poren kommen, welche bevorzugt an den Grenzen der überlappenden punktuellen Keramikflächen entstehen. Dies ermöglicht das Eindringen ätzender (flüssiger) Medien an die Leichtmetalloberfläche, was zu Korrosionsreaktionen führen kann. Somit ist die vollständige Homogenität der Oberflächenbeschichtung unter Ausschluss der Bildung von Poren von höchster Bedeutung für die Schutzeigenschaften der gebildeten Oxidschicht.
Der Prozess der plasmaelektrolytischen Oxidation basiert grundlegend auf der Verwendung verdünnter Lösungen nichttoxischer Ionen (wie Silikate, Aluminate, Phosphate) als Elektrolyt was ihn zu einer besonders umweltfreundlichen Methode zur Oberflächenbehandlung macht. Der nachteilige Aspekt ist der relativ hohe Energiebedarf, welcher wesentlich höher als bei klassischen galvanischen Prozessen ist. Dies ist auf die vergleichbar hohen, angelegten Potentiale im Bereich zwischen 400 V und 500 V (in Einzelfällen sogar höher) zurückzuführen. Damit verbunden sind entsprechend leistungsfähige Gleichrichtersysteme und Kühlanlagen und entsprechend hohe Investitionskosten bei der Skalierung in den industriellen Maßstab. Die Prozesstemperatur ist ein kritischer Faktor und wirkt sich auf die Qualität der hergestellten Schichten aus. Ein (unkontrollierter) Temperaturanstieg während der plasmaelektrolytischen Oxidation sollte aus diesem Grund unbedingt vermieden werden.
Neben der Elektrolytzusammensetzung und der Elektrolyttemperatur hat vor allem der angelegte Strom einen entscheidenden Einfluss auf die Eigenschaften der gebildeten Oxidschicht. Ist die Umsetzung in die keramische Oxidschicht unvollständig, so bilden sich Poren in der Isolatorschicht, welche der Schutzwirkung abträglich sind. Korrosive Medien gelangen durch die Poren an die Substratoberfläche und verursachen dort im schlimmsten Fall Lochfraßkorrosion. Die Problematik der porösen PEO Schichten wurde früh erkannt, jedoch konnte über Gleichstromverfahren keine Abhilfe gefunden werden. Die frühen Anwendungen solcher Schichten lagen deswegen ausschließlich im Bereich der Verschleißschutzschichten.
Ansätze zur Verwendung gab es parallel dazu immer wieder, zu Beginn scheiterten diese an den Unzulänglichkeiten der vorhandenen Pulsgleichrichter. Mit zunehmender Leistungsfähigkeit der Hochleistungselektronik und deren Einzug in die Pulsgleichrichter gab es einen breiten Wechsel von der Gleichstromtechnik zu gepulsten Strömen zur Herstellung von PEO Schichten [27–29].
Die Anwendung von Wechselstrom bzw. bipolaren Pulsen führt auf Grund einer lokalen pH-Wert Erhöhung im kathodischen Teilschritt zu einer Änderung der lokalen Löslichkeiten. Die dadurch resultierenden dichteren Schichten gehen einher mit einer verbesserten Korrosions- stabilität. Eine Erhöhung der Pulsfrequenz verringert durch die damit einhergehende Verringerung der Entladungszeit den lokalen Energieeintrag, was zu einer dichteren Schicht mit verringerter Rauigkeit führt. Die Verwendung von Trapezpulsen anstelle von Rechteckpulsen eliminiert potenziell schädliche Stromspitzen an den Umschaltpunkten und reduziert die Porenbildung. Über Änderung der Pulsbedingungen können nicht nur die physikalischen Eigenschaften verbessert, sondern auch das Aussehen der Schichten beeinflusst werden. Dabei kann im Zusammenspiel mit der Elektrolytzusammensetzung der Farbton der Schichten von Anthrazit-Schwarz über alle Grautöne bis hin zu einem hellen Weiß variiert werden.
Zusammenfassend sind Pulsmethoden im Bereich der PEO Schichten nicht nur etabliert, sondern geradezu essentiell geworden. Erst die Einführung von einer gepulsten Stromführung hat es möglich gemacht, den Anwendungsbereich von reinen abriebfesten Schichten bzw. porösen Haftvermittlern vor einer Polymerbeschichtung, hin zu dichten, dekorativen und korrosionsstabilen Beschichtungen zu erweitern.
Electrochemical Machining
Elektrochemische Bearbeitung (Electrochemical machining ECM) ist eine Methode zu einem sehr lokalisierten Materialabtrag. Sie findet bei der Präzisionsbearbeitung leitfähiger Materialien (Metalle, Metalllegierungen) eine weit verbreitete Anwendung. Das Werkstück wird in unmittelbarer Nähe der Anode positioniert (Spaltbreite < 1 mm), wobei die Form der Anode entscheidend für den bearbeiteten Bereich ist. Der Spalt ist mit Elektrolytlösung umspült.
Werden ein Strom bzw. ein Potential an diese Anordnung angelegt, so wird das Werkstück unmittelbar in der Nähe der Gegenelektrode aufgelöst. Mit fortschreitender Auflösung wird die Gegenelektrode präzise nachgeführt und so eine konstante Spaltgröße gewährleistet. Auf diese Weise wird die Form der Gegenelektrode direkt auf das Werkstück übertragen. Wichtig ist eine gute Umspülung des Spaltes um Abbau- und Nebenprodukte abzutransportieren und die Löslichkeitsgrenze des Elektrolyten im Spalt nicht zu überschreiten. Zusätzlich bewirkt dieser fortwährende Elektrolytaustausch auch eine gute Abführung der entstehenden Reaktionswärme. Eine schematische Darstellung einer solchen Anordnung ist in Abbildung 6 gezeigt. Der Prozess hat wesentliche Vorteile gegenüber mechanischen Verfahren, es können unter anderem auch schwer bearbeitbare Hartmetalle wie Wolfram oder Refraktärmetalle bearbeitet werden [30–32].
![Abb. 6: Schematische Darstellung des Arbeitsprinzips des elektrochemischen Machinings. Das zu bearbeitende Werkstück (Workpiece) wird in geringem Abstand zur Anode (Tool) platziert. Der Elektrolyt wird in den Spalt zwischen den Elektroden gepumpt. Durch Anlegen eines entsprechenden Stroms wird das Werkstück lokal im Bereich der Anode aufgelöst, wobei durch Nachrücken der Gegenelektrode (Tool Feed) die Größe des Spalts beibehalten wird [1] Abb. 6: Schematische Darstellung des Arbeitsprinzips des elektrochemischen Machinings. Das zu bearbeitende Werkstück (Workpiece) wird in geringem Abstand zur Anode (Tool) platziert. Der Elektrolyt wird in den Spalt zwischen den Elektroden gepumpt. Durch Anlegen eines entsprechenden Stroms wird das Werkstück lokal im Bereich der Anode aufgelöst, wobei durch Nachrücken der Gegenelektrode (Tool Feed) die Größe des Spalts beibehalten wird [1]](/images/stories/Abo-2022-05/gt-2022-05-0030.jpg) Abb. 6: Schematische Darstellung des Arbeitsprinzips des elektrochemischen Machinings. Das zu bearbeitende Werkstück (Workpiece) wird in geringem Abstand zur Anode (Tool) platziert. Der Elektrolyt wird in den Spalt zwischen den Elektroden gepumpt. Durch Anlegen eines entsprechenden Stroms wird das Werkstück lokal im Bereich der Anode aufgelöst, wobei durch Nachrücken der Gegenelektrode (Tool Feed) die Größe des Spalts beibehalten wird [1]
Abb. 6: Schematische Darstellung des Arbeitsprinzips des elektrochemischen Machinings. Das zu bearbeitende Werkstück (Workpiece) wird in geringem Abstand zur Anode (Tool) platziert. Der Elektrolyt wird in den Spalt zwischen den Elektroden gepumpt. Durch Anlegen eines entsprechenden Stroms wird das Werkstück lokal im Bereich der Anode aufgelöst, wobei durch Nachrücken der Gegenelektrode (Tool Feed) die Größe des Spalts beibehalten wird [1]
Als Elektrolyte dienen meist neutrale Salzlösungen, die Auflösung findet oft im transpassiven Bereich (unter Sauerstoffentwicklung) statt. Passivierende Elektrolyte wie NaClO3 oder NaNO3 werden allerdings mittlerweile oft bevorzugt, da sie zu präziseren Ergebnissen führen. Die Nebenreaktion der Sauerstoffentwicklung reduziert die Stromausbeute, an der Kathode anhaftende Abbauprodukte verringern die Effizienz des Prozesses und können mitunter zu einer (geometrisch) ungenaueren Auflösung führen. Etwaige Anlagerungen schwerlöslicher Abbauprodukte an der Anode (dem Werkstück) würden dem elektrochemischen Abtrag entgegenwirken und müssen deshalb umgehend aus dem Spalt entfernt werden. So kann es durch Ablagerungen im Spalt zu Kurzschlüssen oder zu erhöhtem Wärmeeintrag kommen (bis hin zu siedenden Elektrolyten). Allgemein ist dieser rein elektrochemische Bearbeitungsprozess sehr schnell, die Prozesszeiten liegen meist im Bereich von Sekunden bis hin zu wenigen Minuten [30, 31].
Elektrochemisches Machining wird klassisch unter Gleichstrombedingungen durchgeführt. Allerdings gibt es kaum einen Prozess bei dem gepulste elektrochemische Verfahren einen so deutlichen Vorteil gegenüber Gleichstrom zeigen.
Maßgebliche Vorteile des gepulsten Elektrochemischen Machining sind, wie durch eine Vielzahl an Studien und Praxisberichten belegt, eine Erhöhung der Bearbeitungsgenauigkeit, dem Abtransport von Reaktionsnebenprodukten und ein verbessertes Thermomanagement.
Für die Präzision der Bearbeitung ist in erster Linie die Stromverteilung über das Werkstück von großer Bedeutung. Diese kann durch Verringerung der Spaltbreite erreicht werden. Puls-ECM-Anlagen stabilisieren den Prozess bei geringeren Spaltbreiten insbesondere über die Pulspause welche eine Regeneration des Elektrolyten im Spalt und den Temperaturausgleich erlaubt. Über eine gezielte Auswahl der angewandten Prozessparameter (wie die Wahl der dominierenden Stromdichteverteilung) kann der Prozess zusätzlich gesteuert werden.
Im Abtransport von Nebenprodukten und der Möglichkeit zum Wärmeausgleich liegen wohl die größten Vorteile der gepulsten Stromführung [33]. Im einfachsten Fall reicht eine Pulspause, um anhaftendes Gas, schwerlösliche Reaktionsprodukte oder einfach Metallionen abzutransportieren. Die Wahl der Länge der Pulspause hängt dabei einerseits von den entstehenden Nebenprodukten und andererseits von der Austauschrate des Elektrolyten im Spalt ab. Da der Elektrolyt auf konstanter Temperatur gehalten wird, hat die Pulspause auch einen kühlenden Effekt (Abtransport der Reaktionswärme). Die Wirkung der Pulspause kann unterstützt werden, indem das Werkzeug (bzw. die Gegenelektrode) während der Pulspause zurückgezogen und so der Spalt vergrößert wird [1, 33]. Hier sind mechanische Grenzen gesetzt, die Pulspausen müssen in diesem Fall im Bereich von Sekunden liegen. Die Auszeit kann bei einem solchen Ansatz auch zur Positionskorrektur und zur Nachjustierung des Spaltes genutzt werden [1, 33]. Reicht die Einführung einer Pulspause nicht aus, um die Elektrodenoberfläche ausreichend von Nebenprodukten zu reinigen, so kann der Effekt durch Umpolung des Werkstücks verstärkt werden. Die macht z.B. bei schwerlöslichen Nebenprodukten Sinn, durch die Umpolung werden die Reaktionsprodukte defacto „abgesprengt“. Die Wahl der Parameter ist in diesem Fall besonders wichtig, um ein zu großes Ausmaß an bei der Umpolung an der Werkstückoberfläche entstehendem Wasserstoff zu verhindern.
Elektrochemisches Machining kann auch zur Herstellung sehr feiner Strukturen in der Größenordnung von Mikrometern verwendet werden [34, 35]. Hierbei wird als Werkstück meist eine metallisierte Waferplatte verwendet, welche mit einer isolierenden Polymermaske (Photoresist) selektiv abgedeckt ist. Der generelle Aufbau ähnelt wieder dem allgemeinen Set-Up (siehe vorstehend). Die anodische Auflösung findet in jenen Bereichen des Werkstücks statt welche frei liegend nicht von der Maskierung abgedeckt werden. Solche Ätzverfahren sind auch auf rein chemischer Basis bekannt, jedoch kommt es hier durch die vorherrschende Isotropie des Ätzprozesses rasch zu einer Unterwanderung der Maskierung und somit zu ungenauen Ergebnissen. Der elektrochemische Prozess weist hingegen eine ausgeprägte Anisotropie auf, die Strukturen werden sehr präzise abgebildet. Die Anisotropie wird durch Anwendung von gepulstem Strom nochmals verstärkt, eventuell auftretenden Passivierungseffekten wird über Umkehrpulse entgegengewirkt.
Auch die umgekehrte Vorgehensweise ist bekannt. Hierbei wird die Gegenelektrode maskiert und das unmaskierte Werkstück bearbeitet [36]. Bei diesem Aufbau spielt die Weite des Spaltes eine noch bedeutendere Rolle, dieser sollte unter 0,5 mm liegen. Nur über Anwendung von Strompulsen in einem eher schlecht leitenden Elektrolytmedium konnten gute Ergebnisse mit steilen Ätzflanken erreicht werden.
Oberflächennachbearbeitung 3D-gedruckter Metallbauteile
Bei der Industrialisierung des metallischen 3D-Drucks ist das Post-Processing nach wie vor eine der größten Herausforderungen. Die derzeit zumeist eingesetzten manuellen mechanischen Bearbeitungsschritte sind hinsichtlich Qualitätssicherung und Skalierbarkeit nicht großserientauglich, Hinterschnitte komplexer Bauteile oder Innenräume können nur durch nasschemische-elektrochemische Verfahren behandelt werden. Ausgehend von einem CAD File wird bei der Transformation in ein Druckfile das Post-Processing nur in den seltensten Fällen berücksichtigt. Entscheidend ist, dass kein einziges 3D-gedrucktes Bauteil direkt nach dem Druck in die (industrielle) Verwendung übergeführt werden kann. Die Oberflächenrauhigkeit nach dem Drucken liegt in der Regel weit über technisch einsetzbaren Werten bei Ra > 100 µm. Druck- bedingt notwendige Stützstrukturen müssen ebenso vom Bauteil entfernt werden wie anhaftende Pulverreste. Erschwerend kommt hinzu, dass die Orientierung des Werkstücks einen starken Einfluss auf die Oberflächenrauheit hat. So gibt es starke Unterschiede zwischen der Oberseite des gedruckten Bauteils und der Unterseite (Up-skin – down-skin Effekte), wobei letztere Flächen deutlich rauer sind.
Ein erster Ansatz zur Endbearbeitung solcher Bauteile war die klassische (thermodynamisch kontrollierte) Elektropolitur. Die nach dem Druck vorliegende Rauhigkeit ist jedoch zu groß für ein direktes Elektrolpolieren und muss deswegen erst mittels anderer Methoden wie mechanischer Bearbeitung oder Strahlprozesen reduziert werden. Ebenso müssen oben genannte Stützstrukturen erst mechanisch entfernt werden. Damit bleibt als Bearbeitungsschritt für das Elektropolieren nur die Feineinebnung, das Polieren. Dies kann ein klassisches Elektropolieren in wässrigen Medien oder ein Elektropolieren in leitfähigen Polymerkügelchen (DLyte-Prozess) sein. Die Oberflächen werden durch diese Prozesse von einem moderaten Ausgangsniveau von Ra etwa 2 µm auf eine finale Rauheit von meist 0,3 µm geglättet. Hinderlich sind dabei aus dem Druck und der daraus resultierenden Materialstruktur hervorgerufene Phänomene. Der Aufbau des Werkstücks aus dem Pulver, Linie für Linie, hat eine spezifische Welligkeit zur Folge. Diese Welligkeit wird unter thermodynamischer Kontrolle nicht als Rauhigkeit erkannt und deswegen nicht entfernt. Es entsteht eine glatte „Hügellandschaft“ an der Oberfläche welche mitunter problematisch für den technischen Einsatz sein kann. Mit thermodynamischen (Gleichstrom) Methoden kann dieses Ergebnis jedoch nicht weiter verbessert werden. Erst die Kombination mit mechanischen Verfahren wie Gleitschleifen vor oder nach dem Elektropolieren liefert dann auch makroskopisch glatte Oberflächen.
Auch hier kann die gepulste Elektrochemie bestehende Grenzen überwinden. Gerade beim Entfernen von Stützstrukturen ist eine gepulste Stromführung bei der Auflösung durch die Möglichkeit der Beeinflussung des Potentialfelds und der am Bauteil anliegenden Feldlinienverteilung ein leistungsstarkes Werkzeug.
Der prominenteste Vertreter einer dynamischen elektrochemischen Nachbearbeitung ist dabei das Hirtisieren. Abbildung 7 zeigt den schematischen Aufbau bei dem Prozess Hirtisieren. Das Bauteil wird ähnlich wie bei dem Elektropolieren leitfähig kontaktiert und als Anode geschaltet. Durch Anlegen von Pulsstrom und teilweise in Kombination mit einem chemischen Angriff über die Wahl der eigens abgestimmten Prozessmedien, werden Stützstrukturen und Pulverreste entfernt und die Oberfläche eingeebnet.
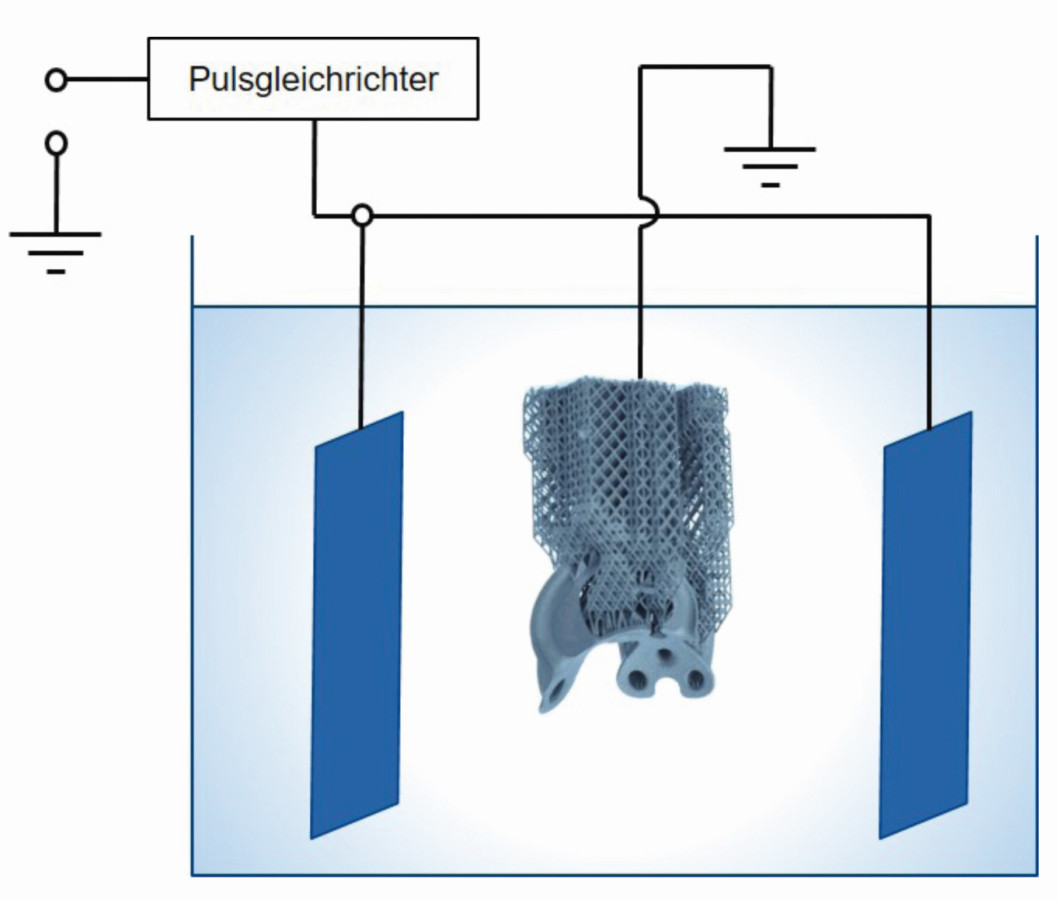 Abb. 7: Schematischer Aufbau beim Hirtisieren. Das Bauteil wird ähnlich wie beim Elektropolieren leitfähig kontaktiert und als Anode geschaltet. Durch Anlegen von Pulsstrom und teilweise in Kombination mit einem chemischen Angriff über die Wahl der eigens abgestimmten Prozessmedien, werden Stützstrukturen und Pulverreste entfernt und die Oberfläche eingeebnet
Abb. 7: Schematischer Aufbau beim Hirtisieren. Das Bauteil wird ähnlich wie beim Elektropolieren leitfähig kontaktiert und als Anode geschaltet. Durch Anlegen von Pulsstrom und teilweise in Kombination mit einem chemischen Angriff über die Wahl der eigens abgestimmten Prozessmedien, werden Stützstrukturen und Pulverreste entfernt und die Oberfläche eingeebnet
Gestützt auf einer gepulsten Stromführung und kombiniert mit chemischer Auflösung können mit diesem Verfahren auch innen liegende Stützstrukturen gezielt aufgelöst werden. Neben der Entfernung dieser Stützstrukturen sowie der Entfernung von Pulverresten wird auch die Oberfläche des Bauteils bis auf ein industriell akzeptables Niveau eingeebnet [37–39]. Ohne Anwendung von Pulsstrom wäre dieses Verfahren nicht denkbar und würde den selben Einschränkungen wie gleichstromgeführtes Elektropolieren unterliegen. Durch die Möglichkeit zur Bearbeitung von geometrisch schwer zugänglichen Bereichen und Innenräumen der Bauteile, wirkt dieses chemisch- elektrochemische Verfahren als Enabler neuer Bauteilgeometrien und unterstützt so die Designfreiheit und damit einer der wichtigsten Stärken des 3D-Drucks.
Zusammenfassung
Mittels Pulsstrom geführte elektrochemische Prozesse entwickeln sich nur langsam aus Nischenbereichen heraus in die allgemeine Galvanotechnik. Innerhalb von Nischen und für ganz bestimmte Anwendungen sind sie aus der industriellen Fertigung allerdings nicht mehr wegzudenken und wirken in vielen Bereichen als Ermöglicher einer Fertigung komplexer Bauteile.
Stand zu Beginn der Einführung gepulster elektrochemischer Verfahren noch die Pulsabscheidung im Fokus, so sind es heute eine Vielzahl an Anwendungen. Besonders stark haben sich Pulsverfahren bei anodischen Bearbeitungen metallischer Bauteile etabliert. Die Kontrolle einer anodischen Auflösung oder Passivierung über Pulsverfahren bietet gegenüber gleichstromgeführten Prozessen eine Vielzahl an Vorteilen. Die moderne Gleichrichtertechnik stellt keine Einschränkung mehr dar und ist in der Lage gepulste Prozesse beliebig zu unterstützen. Anders als ursprünglich angenommen, mit einer untergeordneten Rolle der Pulsabscheidung, bilden gepulste elektrochemische Prozesse heute ein wichtiges Standbein in der elektrochemischen Oberflächentechnik.
Literatur
[1] W.E.G. Hansal; S Roy: Pulse Plating, Eugen G. Leuze Verlag, Bad Saulgau, F.R.G., 2012
[2] D. Landolt: Electrochimica Acta, 248 (2017) 75
[3] M. Datta: IBM J. Res. Develop., 37 (1993) 207
[4] M. Buhler;, A. Rettinghaus; T. Hinte; A. Visser: Journal PCMI, 95 (2004), 5
[5] W.E.G. Hansal, Eurofinish, Bremen, 2009
[6] W.E.G. Hansal: Schriftenreihe Werkstoffe und werkstofftechnische Anwendungen, (Hrsg. T. Lampke) 2018, 80
[7] A. Bhuyan; B. Gregory; H. Lei; S.Y. Yee; Y.B. Gianchandani: IEEE Sensors, 2005, 314
[8] N. Eliaz; O. Nissan; J. Biomed. Mater. Res, 83A (2007), 546
[9] A. Lozano-Morales; M. Inman; E.J. Taylor: Plat. Surf. Fin., 96 (2009), 5
[10] H. Kaesche: Corrosion of Metals: Physiochemical Principles and Current Problems, Springer, Berlin, 2003
[11] M. Madou: Fundamentals of Microfabrication, 2nd Edition, CRC Press, 2002
[12] G.D. Sulka in Nanostructured Materials in Electrochemistry (Editor A. Eftekhar), Wiley-VCH, 2008
[13] W. Lee: J. Electron. Mater., 62 (2010), 57
[14] D. Landolt: Corrosion and Surface Chemistry of Metals, EPFL Press, Lausanne, 2007
[15] J.W. Diggle; T.C. Downie; C.W. Goulding: Chemical Reviews, 69 (1969), 365
[16] P.G. Sheasby; R. Pinner: The Surface Treatment and Finishing of Aluminium and its Alloys, 6th Edition, ASM International, 2001
[17] A.D Juhl: Pulse Anodising of Extruded and Cast Aluminium Alloys, PhD Thesis,Technical University of Denmark, 1999
[18] J.F. Murphy; C.E. Michelson: Conference on Anodising, Nottingham, 1961
[19] H. Takahashi:;M. Nagayama; H. Akahori; A. Kitahara: J. Electron. Microscopy, 22 (1973), 149
[20] K. Yokoyama; H. Konno; H. Takahashi; M. Nagayama: Proceedings of 2nd International Symposium on Pulse Plating, 1982
[21] K. Yokoyama; H. Konno; H. Takahashi; M. Nagayama: Plat. Surf. Fin., 7 (1982), 62
[22] C. Colombini: Finishing, 12 (1988), 34
[23] C. Colombini: Metal Finishing, 90 (1992), 31
[24] R. Mann; W.E.G. Hansal; S. Hansal: Transactions of the IMF, 92 (2014), 297–304
[25] N. Godja; N. Kiss; C. Löcker; A. Schindel; A. Gavrilovic; J. Wosik; R. Mann; J. Wendrinsky; A. Merstallinger; G.E. Nauer: Tribology International, 43 (2010), 1253-1261
[26] N. Godja; W.E.G. Hansal; R. Mann; C. Kleber; S. Hansal: Transactions of the IMF, 91 (2013), 321–329
[27] 46. P. Shashkow; G. Khomutov; A. Yerokhin; S. Usov: Patent PCT/GB2012/050268, 2012
[28] 47. R. Mann;, W.E.G. Hansal; S. Hansal: Patent PCT/AT2016/050188, 2016
[29] A.L. Yerokhin; X. Nie; A. Leyland; A. Matthews; S.J. Dowey: Surf. Coat. Technol., 122 (1999), 73
[30] A.D. Davydov; V.M. Volgin; V.V. Lyubimov: Russ. J. Electrochem., 40 (2004), 1438
[31] C. van Osenbruggen; C. de Regt: Philip Tech. Rev., 42 (1985), 22
[32] K.P. Rajurkar; D. Zhu; J.A. McGeough; J. Kozak; A. De Silva: Annals of the CIRP, 48 (1999), 567
[33] J. Kozak; K.P Rajurkar; B. Wei: J. Eng. for Industry, 116 (1994), 316
[34] M. Datta; R.V. Shenoy; L.T. Romankiw: J. Eng. for Industry, 118 (1996), 29
[35] M. Datta: IBM J. Res. Develop., 42 (1998) , 563
[36] I. Schönenberger; S. Roy: Electrochim. Acta., 51 (2005), 809
[37] W.E.G. Hansal: Jahrbuch Oberflächentechnik, (Hrsg. T. Sörgel) 2019, 75, 48
[38] W.E.G. Hansal: X-Technik Additive Fertigung, 2 (2019), 12
[39] W.E.G. Hansal: X-Technik Additive Fertigung, 4 (2019), 24













