Aluminium gilt als vielversprechender Ersatz für umweltbedenkliche Korrosionsschutzschichten aus Cadmium. Aufgrund der Bildung einer isolierenden Oxidschicht kann Aluminium unter Umgebungsbedingungen allerdings keinen kontinuierlichen kathodischen Korrosionsschutz bieten und muss daher legiert werden. Aus AlCl3/1-Ethyl-3-methylimidazoliumchlorid abgeschiedene Aluminium-Zink-Legierungen bieten kathodischen Korrosionsschutz unter atmosphärischen Bedingungen [1]. Die Zementation von Zink auf Aluminiumanoden führt zu einer rapiden Abnahme der Zinkionenkonzentration im Elektrolyten und Komplexbildner für ionische Flüssigkeiten sind noch nicht ausreichend untersucht. Daher ist eine angepasste Prozessführung notwendig um die Abscheidung von Legierungsschichten mit reproduzierbarer Zusammensetzung zu gewährleisten.
Multianoden aus den Legierungsmetallen Aluminium und Zink wurden zur Abscheidung von AluminiumZink-Legierungen eingesetzt, wodurch der Zinkionengehalt im Elektrolyten über einen langen Zeitraum stabilisiert werden konnte. Die Anpassung des Stromverhältnisses zwischen Aluminium- und Zinkanoden lässt zudem eine gezielte Abscheidung von Legierungen unterschiedlicher Zusammensetzung zu. Numerische Simulationen belegen, dass segmentierte Multianoden keinen Einfluss auf die kathodische Stromdichteverteilung haben und daher das qualitative Schichtwachstum nicht beeinträchtigen.
Galvanische Abscheidung von Aluminium
Die elektrochemische Abscheidung von Aluminium und seinen Legierungen birgt ein enormes Potenzial für verschiedene industrielle Anwendungen. Aufgrund ihrer geringen Dichte, ihrer hohen thermischen und elektrischen Leitfähigkeit, ihrer guten Korrosionsbeständigkeit und ihrer dekorativen Eigenschaften werden diese Werkstoffe heutzutage häufig verwendet.
Aufgrund politischer Regulierungen umweltschädlicher Materialien, z. B. Cadmium (REACh Verordnung), wächst das Interesse an unbedenklichen Alternativen. Entsprechend intensiv wird an neuen Technologien geforscht. Aluminium ist einer der vielversprechendsten Ersatzstoffe für Cadmium im kathodischen Korrosionsschutz von Stahl [2–4]. Es bietet aufgrund seiner effektiven Selbstpassivierung einen hervorragenden passiven Korrosionsschutz. Ein kathodischer Korrosionsschutz mit reinem Aluminium ist jedoch nicht möglich [5, 6]. Die sich in Kontakt mit Luft bildende Passivschicht, bestehend aus einer dichten, elektrisch nicht-leitfähigen Al2O3 Schicht (ca. 10 nm), unterbricht den lokalen Stromkreis und verhindert somit eine opferanodische Schutzwirkung. Standardmethoden, wie Immersionstests und der neutrale Salzsprühtest, können die Leistungsfähigkeit von Aluminium für den kathodischen Korrosionsschutz nicht zuverlässig wiedergeben. Hohe Chloridkonzentrationen führen dazu, dass die Oxidschicht gestört und das Material aktiviert wird. Ein scheinbar guter kathodischer Schutz ist die Folge, der unter vergleichsweise milden Umweltbedingungen nicht gegeben ist.
Die Bildung der Oxidschicht kann durch Legieren behindert werden. Das führt allerdings zu einer höheren Eigenkorrosion der Legierungen [6]. Potenziell geeignete Legierungselemente sind Zink [1, 5–9] und Zinn [1, 6]. Aluminium-Zink-Legierungen (AlZn) [1, 10–13] wurden bereits erfolgreich aus ionischen Flüssigkeiten (engl. ionic liquids, ILs) und Salzschmelzen abgeschieden. Auch die Abscheidung von Aluminium-Zinn-Legierungen (AlSn) aus ILs [1], Mischungen von Ethylenglykol/Cholinchlorid [14], organischen Lösungsmitteln [15] und Salzschmelzen [16, 17] wurde berichtet.
Aluminium hat ein sehr negatives Nernst-Potential (-1,66 V vs. Normalwasserstoffelektrode [18]) und kann daher nicht aus wässrigen Lösungen abgeschieden werden. Nichtwässrige Elektrolyte bieten breitere elektrochemische Fenster (> 3 V), die die elektrochemische Abscheidung reaktiver Metalle, z. B. Aluminium, Niob und Tantal, ermöglichen. Die ersten elektrochemischen Verfahren zur Aluminiumabscheidung im industriellen Maßstab waren das SIGAL-Verfahren [19–21] und das REAL-Verfahren [22, 23]. Trotz der erfolgreichen Hochskalierung sind diese Verfahren teuer und weisen hohe technische Anforderungen sowie einen hohen Wartungsaufwand auf, da sie auf flüchtigen und leicht entzündlichen Verbindungen (Toluol, Ether) basieren. Außerdem haben sie ein begrenztes Potenzial als Elektrolyte für die Abscheidung von Legierungen, da sensible chemische Reaktionen durch Zugabe weiterer Legierungselemente gestört werden [22, 23].
Die Abscheidung von Metallen und Legierungen aus ILs ist in den letzten Jahrzehnten intensiv untersucht worden. ILs haben sich als vielversprechende Elektrolyte für die Abscheidung von Aluminium und seinen Legierungen erwiesen [24]. Ein niedriger Dampfdruck, gute elektrische Leitfähigkeit, hohe Löslichkeit für viele Metallsalze und schwere Entflammbarkeit sind nur einige ihrer vorteilhaften Eigenschaften [25–27].
Die elektrochemische Abscheidung von Aluminium aus ILs auf Imidazoliumbasis, z. B. Mischungen aus AlCl3 und 1-Ethyl-3-methylimidazoliumchlorid ([EMIm]Cl), ist nur aus Lewissauren Elektrolyten möglich, in denen sich durch einen molaren Überschuss von AlCl3 Heptachloroaluminationen (Al2Cl7-) bilden (Gl. 1) [28–30].
4 Al2Cl7- + 3 e- → Al + 7 AlCl4– <1>
Die Zugabe weiterer Salze (z. B. ZnCl2) ermöglicht die Abscheidung von Aluminiumlegierungen. Während der Legierungsabscheidung sinkt die Konzentration der gelösten Ionen des Aluminiums sowie des Legierungsmetalls. Der Einsatz von Komplexbildnern würde die reproduzierbare Abscheidung von Legierungen mit definierter Zusammensetzung ermöglichen, indem sie das Verhältnis der Metallionen näherungsweise konstant halten. Für ILbasierte Elektrolyten steht die Erforschung der Komplexbildner jedoch noch am Anfang. Durch den Einsatz löslicher Aluminiumanoden kann ein kontinuierlicher Prozess geschaffen werden, der die Lebensdauer des Elektrolyten verlängert, da keine schädlichen Nebenreaktionen an der Anode ablaufen (z. B. Chlorbildung). Gleichzeitig wird jedoch das Legierungselement zunehmend durch Aluminium ersetzt. Die häufige Nachdosierung des entsprechenden Metallsalzes wirkt der Verarmung entgegen, bringt allerdings auch Chloridionen (Cl-) in den Elektrolyten ein. Diese reagieren mit den elektrochemisch aktiven Al2Cl7–(Gl. 2).
Al2Cl7– + Cl- → 2 AlCl4– <2>
Dieser kontinuierliche Umsatz von Al2Cl7– zu AlCl4- führt letztlich dazu, dass keine Al2Cl7- für die Aluminiumreduktion (Gl. <1>) zur Verfügung stehen und bringt die Legierungsabscheidung somit zum Erliegen.
Viele Metalle lassen sich mit hoher Stromausbeute anodisch in ILs auflösen und somit als lösliche Anoden einsetzen [31]. Der Ersatz von Aluminiumanoden durch das Legierungselement der abzuscheidenden Legierung würde zu einer kontinuierlichen Zunahme der entsprechenden Ionen im Elektrolyten führen und damit die Reproduzierbarkeit der Abscheidung negativ beeinflussen. Multianoden hingegen sind eine elegante Methode der Elektrolytverarmung entgegenzuwirken, somit die Legierungs-abscheidung zu stabilisieren und gleichzeitig die Vorteile des kontinuierlichen Prozesses (Vermeidung schädlicher Nebenreaktionen) beizubehalten sowie die Einbringung von Chloridionen in den Elektrolyten zu vermeiden.
Dieser Beitrag diskutiert den Einsatz von Multianoden für die Abscheidung von AlZn aus AlCl3/[EMIm]Cl–ILs. Dabei werden Einfach- und Doppelanoden aus Aluminium- bzw. Aluminium- und Zinkmetall verglichen und aufgezeigt, dass segmentierte Mutianoden prozessstabilisierend wirken, aber keinen Einfluss auf die Schichtverteilung nehmen.
Ergebnisse der Versuche
Im zyklischen Voltammogramm einer Wolfram-Elektrode in einem AlCl3/[EMIm]Cl-Elektrolyten (Abb. 1) ist die Reduktion von Aluminium (C1 und C2) zu erkennen. Bei Zugabe von ZnCl2 ist ein zusätzlicher Reduktionspeak (C3) zu beobachten, welcher im Vergleich zur Aluminiumreduktion einige 100 mV anodischer liegt. Darüber hinaus sind die entsprechenden Oxidationspeaks (A1, A2 und A3) in anodischen Bereich zu erkennen. Die Zugabe von ZnCl2 zum Elektrolyten bewirkt die Erniedrigung der Aluminiumreduktions- bzw. Oxidationspeaks. Das ist auf die in Gleichung <2> beschriebene Reaktion der eingebrachten Chloridionen zurückzuführen.
![Abb. 1: Zyklisches Voltammogramm (100 mV s-1) einer Wolfram-Elektrode in AlCl3/ [EMIm] Cl (blau) sowie AlCl3 [EMIm] Cl mit 10 mmol l–1 ZnII (grün) bzw. mit 50 mmol l–1 ZnII (grün- gestrichelt). Der eingezeichnete qualitative Trend der Peakpositionen hat keine physikalische Bedeutung. Der Pfeil gibt die Scan-Richtung an [1] Abb. 1: Zyklisches Voltammogramm (100 mV s-1) einer Wolfram-Elektrode in AlCl3/ [EMIm] Cl (blau) sowie AlCl3 [EMIm] Cl mit 10 mmol l–1 ZnII (grün) bzw. mit 50 mmol l–1 ZnII (grün- gestrichelt). Der eingezeichnete qualitative Trend der Peakpositionen hat keine physikalische Bedeutung. Der Pfeil gibt die Scan-Richtung an [1]](/images/stories/Abo-2022-10/gt-2022-10-0202.jpg) Abb. 1: Zyklisches Voltammogramm (100 mV s-1) einer Wolfram-Elektrode in AlCl3/ [EMIm] Cl (blau) sowie AlCl3 [EMIm] Cl mit 10 mmol l–1 ZnII (grün) bzw. mit 50 mmol l–1 ZnII (grün- gestrichelt). Der eingezeichnete qualitative Trend der Peakpositionen hat keine physikalische Bedeutung. Der Pfeil gibt die Scan-Richtung an [1]
Abb. 1: Zyklisches Voltammogramm (100 mV s-1) einer Wolfram-Elektrode in AlCl3/ [EMIm] Cl (blau) sowie AlCl3 [EMIm] Cl mit 10 mmol l–1 ZnII (grün) bzw. mit 50 mmol l–1 ZnII (grün- gestrichelt). Der eingezeichnete qualitative Trend der Peakpositionen hat keine physikalische Bedeutung. Der Pfeil gibt die Scan-Richtung an [1]
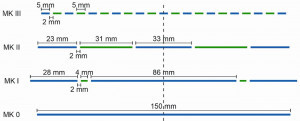 Abb. 2: Verschiedene Multianodendesigns bestehend aus Al- (blau) und Zn-Metall (grün)Für die Beschichtung von Stahlsubstraten wurden ausgehend von Einzelanoden aus Aluminiummetall (Abb. 2, MK0) verschiedene Multianodendesigns erstellt. Diese unterscheiden sich im Flächenverhältnis von Aluminium- zu Zinkmetall (Abb. 2, MKI–MKIII). Bei einer Zinkionenkonzentration von 10 mmol l-1 bzw. 0,65 g l-1 ergeben sich für AlZn-Schichten typischerweise Zinkanteile im einstelligen Gewichtsprozentbereich. Auf Basis des Faraday-Gesetzes (und Annahme einer Stromausbeute von 100 %) lässt sich der Ladungsanteil berechnen, der auf die Zinkreduktion bei der Legierungsabscheidung entfällt. Dieser liegt bei ca. 2 % (Abb. 3a). Daraus folgte das Multianodendesign MKI (Abb. 2), welches einen entsprechend niedrigen Flächenanteil des Zinkmetalls aufwies. Es zeigte sich allerdings, dass der Zinkionenanteil im Elektrolyten derart schnell absinkt, dass Legierungen mit ca. 60–70 Gew. % Zink abgeschieden werden müssten (Nebenbild in Abb. 3a), sofern es keine konkurrierenden Reaktionen gibt. Das deutet darauf hin, dass eine parasitäre Reduktion von Zinkionen parallel zur elektrochemischen Reduktion an der Kathode erfolgt. Der Grund hierfür liegt wahrscheinlich im Unterschied der Redoxpotentiale von Aluminium und Zink von wenigen 100 mV (Abb. 1). Das führt zur Zementation von Zink auf dem Aluminiummetall der Anoden. Auf diesen bildet sich mit der Zeit ein zinkhaltiger, schlecht haftender, schwarzer Film. Um die parasitäre Zinkreduktion auszugleichen, wurde das Multianodendesign MKII mit einem größeren Flächenanteil des Zinkmetalls erstellt. Durch gezielte Anpassung des Stromverhältnisses IAl:IZn zwischen dem Aluminium- und dem Zinkmetall wird die Zinkveramung ausgeglichen und so eine äußerst geringe Variation der Zinkionenkonzentration über eine Vielzahl von Abscheidungen hinweg erreicht (Abb. 3b). Mit steigendem Zinkstromanteil kann zudem eine einfache Anpassung der Zinkionenkonzentration im Elektrolyten und damit der Legierungszusammensetzung erzielt werden. Damit ist die Abscheidung maßgeschneiderter Legierungen für verschiedene Anwendungen mittels eines einzelnen Versuchsaufbaus und ohne zusätzliche Komplexbildner möglich. Auch die Abscheidung ternärer Legierungen ist auf diese Weise denkbar, erfordert allerdings eine detaillierte Untersuchung der nötigen Stromverhältnisse und möglicher Zementationserscheinungen.
Abb. 2: Verschiedene Multianodendesigns bestehend aus Al- (blau) und Zn-Metall (grün)Für die Beschichtung von Stahlsubstraten wurden ausgehend von Einzelanoden aus Aluminiummetall (Abb. 2, MK0) verschiedene Multianodendesigns erstellt. Diese unterscheiden sich im Flächenverhältnis von Aluminium- zu Zinkmetall (Abb. 2, MKI–MKIII). Bei einer Zinkionenkonzentration von 10 mmol l-1 bzw. 0,65 g l-1 ergeben sich für AlZn-Schichten typischerweise Zinkanteile im einstelligen Gewichtsprozentbereich. Auf Basis des Faraday-Gesetzes (und Annahme einer Stromausbeute von 100 %) lässt sich der Ladungsanteil berechnen, der auf die Zinkreduktion bei der Legierungsabscheidung entfällt. Dieser liegt bei ca. 2 % (Abb. 3a). Daraus folgte das Multianodendesign MKI (Abb. 2), welches einen entsprechend niedrigen Flächenanteil des Zinkmetalls aufwies. Es zeigte sich allerdings, dass der Zinkionenanteil im Elektrolyten derart schnell absinkt, dass Legierungen mit ca. 60–70 Gew. % Zink abgeschieden werden müssten (Nebenbild in Abb. 3a), sofern es keine konkurrierenden Reaktionen gibt. Das deutet darauf hin, dass eine parasitäre Reduktion von Zinkionen parallel zur elektrochemischen Reduktion an der Kathode erfolgt. Der Grund hierfür liegt wahrscheinlich im Unterschied der Redoxpotentiale von Aluminium und Zink von wenigen 100 mV (Abb. 1). Das führt zur Zementation von Zink auf dem Aluminiummetall der Anoden. Auf diesen bildet sich mit der Zeit ein zinkhaltiger, schlecht haftender, schwarzer Film. Um die parasitäre Zinkreduktion auszugleichen, wurde das Multianodendesign MKII mit einem größeren Flächenanteil des Zinkmetalls erstellt. Durch gezielte Anpassung des Stromverhältnisses IAl:IZn zwischen dem Aluminium- und dem Zinkmetall wird die Zinkveramung ausgeglichen und so eine äußerst geringe Variation der Zinkionenkonzentration über eine Vielzahl von Abscheidungen hinweg erreicht (Abb. 3b). Mit steigendem Zinkstromanteil kann zudem eine einfache Anpassung der Zinkionenkonzentration im Elektrolyten und damit der Legierungszusammensetzung erzielt werden. Damit ist die Abscheidung maßgeschneiderter Legierungen für verschiedene Anwendungen mittels eines einzelnen Versuchsaufbaus und ohne zusätzliche Komplexbildner möglich. Auch die Abscheidung ternärer Legierungen ist auf diese Weise denkbar, erfordert allerdings eine detaillierte Untersuchung der nötigen Stromverhältnisse und möglicher Zementationserscheinungen.
![Abb. 3: Theoretischer Stromanteil für Zinkreduktion bei Abscheidung von AlZn gegen resultierenden Zn-Legierungsanteil auf Basis des Faraday-Gesetzes und (b) Verlauf der Zinkionenkonzentration im Elektrolyten (AlCl3/ [EMIm]Cl, molares Verhältnis 1,5:1) gegen die übertragene Ladungsmenge für verschiedene Anoden und Stromverhältnisse IAl: IZn Abb. 3: Theoretischer Stromanteil für Zinkreduktion bei Abscheidung von AlZn gegen resultierenden Zn-Legierungsanteil auf Basis des Faraday-Gesetzes und (b) Verlauf der Zinkionenkonzentration im Elektrolyten (AlCl3/ [EMIm]Cl, molares Verhältnis 1,5:1) gegen die übertragene Ladungsmenge für verschiedene Anoden und Stromverhältnisse IAl: IZn](/images/stories/Abo-2022-10/gt-2022-10-0204.jpg) Abb. 3: Theoretischer Stromanteil für Zinkreduktion bei Abscheidung von AlZn gegen resultierenden Zn-Legierungsanteil auf Basis des Faraday-Gesetzes und (b) Verlauf der Zinkionenkonzentration im Elektrolyten (AlCl3/ [EMIm]Cl, molares Verhältnis 1,5:1) gegen die übertragene Ladungsmenge für verschiedene Anoden und Stromverhältnisse IAl: IZn
Abb. 3: Theoretischer Stromanteil für Zinkreduktion bei Abscheidung von AlZn gegen resultierenden Zn-Legierungsanteil auf Basis des Faraday-Gesetzes und (b) Verlauf der Zinkionenkonzentration im Elektrolyten (AlCl3/ [EMIm]Cl, molares Verhältnis 1,5:1) gegen die übertragene Ladungsmenge für verschiedene Anoden und Stromverhältnisse IAl: IZn
Um eine möglichst hohe Flexibilität bezüglich der Flächenanteile zu gewährleisten, wurde die segmentierte Multianode MKIII (Abb. 2) erstellt, die aus sich abwechselnden Aluminium-und Zinkmetallstreifen mit einer jeweiligen Breite von 5 mm und einem Abstand von 2 mm besteht. Die Anordnung der Streifen garantiert eine gleichmäßige Verteilung des elektrischen Feldes im Elektrolyten und der Stromdichte über Anoden- und Kathodenfläche. Die sekundäre Stromdichteverteilung über die Oberfläche beider Elektroden hinweg wurde mithilfe numerischer Simulationen (ComSol Multiphysics) berechnet (Abb. 4). Aufgrund der zuvor diskutierten Vorteile wird im Folgenden ausschließlich die Multianode MKIII im Vergleich zur Einfachanode MK0 diskutiert.
Im Vergleich zu den Kantenbereichen ergeben sich höhere Stromdichten im Zentrum der Anoden. Auf der Kathode hingegen sind hohe Stromdichten vor allem an den Kanten zu verzeichnen (Abb. 4a). Das ist auf die Anordnung der Elektroden zueinander und die resultierende Verteilung des elektrischen Feldes im Elektrolyten zurückzuführen. Die lokale Stromdichte steigt für beide Elektroden mit der aufgeprägten Gesamtstromdichte linear an, die Verteilung bleibt qualitativ identisch. Das bedeutet, dass eine Verdopplung des Gesamtstroms an jedem Ort der Elektroden zur Verdopplung der lokalen Stromdichte führt. Mit steigendem Abstand zwischen Anode und Kathode ändert sich die Stromdichteverteilung an der Kathodenoberfläche nicht. Die Verteilung über die Anode allerdings ist bei größerem Abstand deutlich flacher ausgeprägt. Das hat zur Folge, dass die Auflösung der Anode gleichmäßiger erfolgt und darüber hinaus lokale hohe Stromdichten bzw. Potentiale vermieden werden können. Dadurch wird unerwünschten anodischen Nebenreaktionen (z. B. Chlorentwicklung) vorgebeugt und die Lebensdauer des Elektrolyten erhöht.
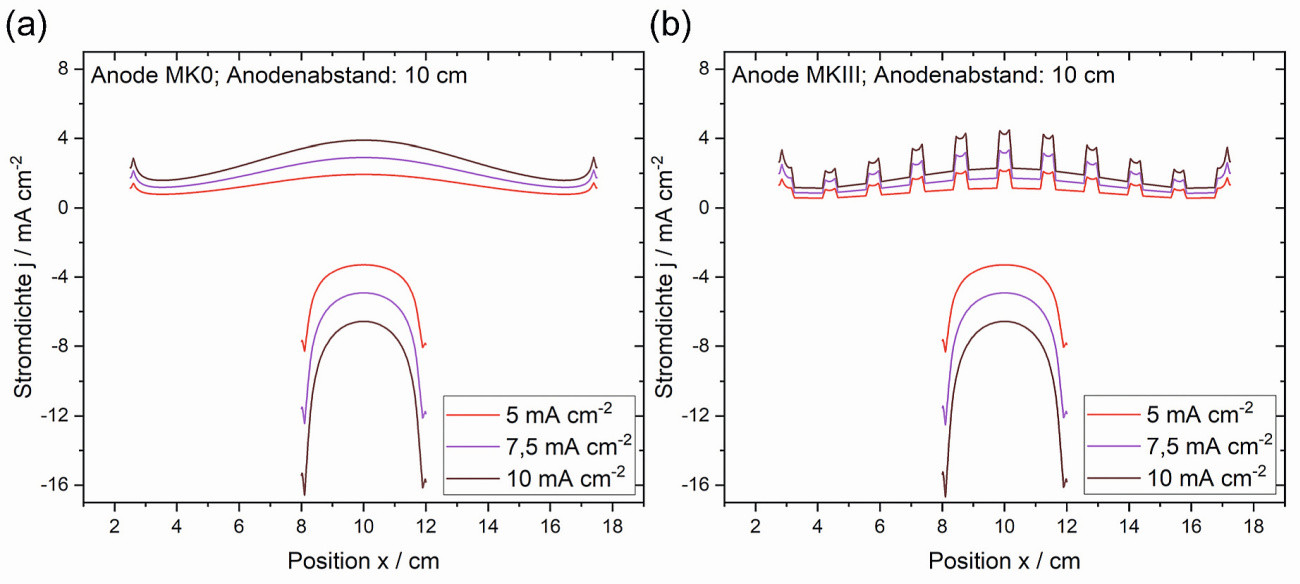 Abb. 4: Stromdichteverteilung über Anode (oben) und Kathode (unten) bei Verwendung einer (a) Einzelanode (MK0) und (b) Multianode (MKIII, IAI:IZn = 60:40) aus Simulation mittels ComSol Multiphysics
Abb. 4: Stromdichteverteilung über Anode (oben) und Kathode (unten) bei Verwendung einer (a) Einzelanode (MK0) und (b) Multianode (MKIII, IAI:IZn = 60:40) aus Simulation mittels ComSol Multiphysics
Es ist bemerkenswert, dass die Stromdichteverteilung über die Kathodenfläche hinweg für Einzel- und Multianoden qualitativ gleich ist und insbesondere die Verteilung über die Kathodenoberfläche identisch ist (Abb. 4a und b). Folglich nehmen Multianoden, wie sie hier eingesetzt wurden, keinen Einfluss auf die Stromdichteverteilung auf der Kathode bzw. auf die resultierende Schichtverteilung.
Zusammenfassung
Im Rahmen dieses Beitrages konnte gezeigt werden, dass der Einsatz von Multianoden zur Stabilisierung der Elektrolytzusammensetzung und Steigerung der Reproduzierbarkeit der Aluminiumlegierungsabscheidung in ILs beitragen kann. Aus den Messdaten geht hervor, dass es zur Zementation von Zink auf Aluminiummetall kommt, was die Verarmung der Zinkionen stark beschleunigt, aber durch gezielte Zinkmetalloxidation ausgeglichen werden kann. Dadurch wird die Zinkionenkonzentration über eine lange Zeit in einem engen Konzentrationsbereich stabil gehalten. Numerische Simulationen zeigen, dass die Multianoden, wie sie hier verwendet wurden, zur gleichen Stromdichteverteilung auf der Kathode führen wie es bei Einzelanoden der Fall ist und damit die Schichtdickenverteilung nicht beeinflussen.
Die dargestellten Ergebnisse lassen sich auch auf die Abscheidung weiterer Legierungen übertragen und eröffnen damit die Möglichkeit der reproduzierbaren Abscheidung definierter Legierungen aus ionischen Flüssigkeiten ohne zusätzliche Komplexbildner.
Literatur
[1] Böttcher, R.: Elektrochemische Abscheidung von Aluminium und Aluminiumlegierungen aus ionischen Flüssigkeiten, Dissertation, Ilmenau, 2021
[2] Legg, K.: Cadmium replacement alternatives for the Joint Strike Fighter, Rowan Technology Group, Libertyville, IL, USA, Report (2000)
[3] Metal Finishing 108 (2010) 12–20, https://doi.org/10.1016/S0026-0576(10)00012-7.
[4] Bielewski, M.: Replacing cadmium and chromium, Research and Technology Organization and NATO, RTO-AG-AVT-140 (2011) 1–22
[5] Corrosion Sci. 40 (1998) 1711–1723, https://doi.org/10.1016/S0010-938X(98)00073-0
[6] von Baeckmann, W.; Schwenk, W.; Prinz, W. (Eds.): Handbuch des kathodischen Korrosionsschutzes: Theorie und Praxis der elektrochemischen Schutzfahren, 3rd ed., VCH, Weinheim, 1989
[7] Corrosion Sci. 86 (2014) 231–238, https://doi.org/10.1016/j.corsci.2014.05.016
[8] Surf. Coat. Tech. 150 (2002) 70–75, https://doi.org/10.1016/S0257-8972(01)01508-0
[9] Corrosion Sci. 37 (1995) 79–95, https://doi.org/10.1016/0010-938X(94)00116-N
[10] Electrochim. Acta 211 (2016) 860–870, https://doi.org/10.1016/j.electacta.2016.06.081
[11] Surf. Coat. Tech. 286 (2016) 256–261, https://doi.org/10.1016/j.surfcoat.2015.10.080
[12] Electrochim. Acta 55 (2010) 2158–2162, https://doi.org/10.1016/j.electacta.2009.11.050
[13] Electrochim. Acta 46 (2000) 499–507, https://doi.org/10.1016/S0013-4686(00)00537-5
[14] Electrochim. Acta 54 (2009) 5307–5319, https://doi.org/10.1016/j.electacta.2009.04.028
[15] J. Electrochem. Soc. 134 (1987) 2425–2429, https://doi.org/10.1149/1.2100215
[16] Electrochim. Acta 100 (2013) 281–284, https://doi.org/10.1016/j.electacta.2012.09.069
[17] J. Alloys Compd. 690 (2017) 228–238, https://doi.org/10.1016/j.jallcom.2016.08.104
[18] Lide, D.R. (Ed.): CRC handbook of chemistry and physics: A ready-reference book of chemical and physical data, 76th ed., CRC press, Boca Raton, 1996
[19] Electrochim. Acta 42 (1997) 3–13
[20] Lehmkuhl, H.; Mehler, K.; Landau, U.: The Principles and Techniques of Electrolytic Aluminum Deposition and Dissolution in Organoaluminum Electrolytes, in: Gerischer, H.; Tobias, C.W. (Eds.): Advances in Electrochemical Science and Engineering, Wiley, Weinheim, 1993, 163–226
[21] Z. Anorg. Allg. Chem. 283 (1956) 414–424, https://doi.org/10.1002/zaac.19562830142
[22] J. Appl. Electrochem. 3 (1973) 321–325, https://doi.org/10.1007/BF00613040
[23] Electrochim. Acta 17 (1972) 1343–1352, https://doi.org/10.1016/0013-4686(72)80080-X
[24] Abbott, A.P.; MacFarlane, D.R.; Endres, F. (Eds.): Electrodeposition from ionic liquids, Wiley-VCH, Weinheim, 2017
[25] J. Electrochem. 21 (2015) 172
[26] J. Appl. Polym. Sci. 113 (2009) 2492–2498, https://doi.org/10.1002/app.30226
[27] Ind. Eng. Chem. Res. 47 (2008) 6327–6332, https://doi.org/10.1021/ie800665u
[28] J. Electroanal. Chem. 248 (1988) 431–440, https://doi.org/10.1016/0022-0728(88)85103-9
[29] J. Electrochem. Soc. 133 (1986) 1389–1391, https://doi.org/10.1149/1.2108893
[30] Inorg. Chem. 21 (1982) 1263–1264, https://doi.org/10.1021/ic00133a078
[31] Nat. Sci. - Mater. 25 (2015) 595–602, https://doi.org/10.1016/j.pnsc.2015.11.005













