Die Trocknung der gereinigten Oberfläche
Die Temperaturdifferenz zwischen Objektoberflächen und Raum trocknet infolge der Heißdampfreinigung der Objektoberfläche von Fremdpartikeln durch Konvektion die Objektoberfläche. Die freien, in der Schwade abgesaugten Fremdpartikel sind trocken, die Gefahr des Verklebens ist minimal.
Sattdampf und überhitzter Dampf im Vakuum
Heißdampf im Unterdruck wirkt als Reinigungsmittel auf der Objektoberfläche und verursacht während der Reinigung kaum einen Abfall des Vakuumdruckes im geschlossenen Kammerraum. Der kondensierende Heißdampf erzeugt durch seine Abkühlung selbst Unterdruck. Das kondensierende Wasser und die...Forsetzung auf S. 314
...im Wasser gelösten Fremdpartikel folgen der Schwerkraft der Erde, d. h. am tiefsten Punkt der Vakuumkammer sammeln sich diese. Wird die Vakuumkammer durch eine Reihenschaltung von mindestens zwei Ablasssystemen von Kondensat mit gelösten Fremdpartikeln entleert, wird das Vakuum in der Kammer kaum verändert. Der Dampf entspannt sich von einer Temperatur von 170 °C bis 180 °C und 6,5 bar bis 7 bar in die Vakuumkammer. In der Vakuumkammer sind mindestens 140 mbar bis 990 mbar Unterdruck. Diese Bedingungen lassen den expandierenden Dampf kaum messbar abkühlen und die Abkühlung des Dampfes erzeugt Unterdruck durch Volumenreduktion von Dampf zu Kondensat-Wasser. Der Mantel der Vakuumkammer ist gegen Wärmeverlust isoliert.
Lösen von Öl- und Fettfilmen, Ziehseifen und Wachsen
Schichten und Filme wie z. B. Öle werden bei Temperaturen von höher 85 °C auf der Objektoberfläche flüssiger. Durch den Heißdampfdruck höher 2bar Überdruck auf der Objektoberfläche wird die Filmdicke auf der Oberfläche durch Ablaufen geringer und teilweise in den angrenzenden Raum geblasen. Der Raum hat mindestens einen Unterdruck von 140 mbar. Der Heißdampf folgt als Schwade mit den abgereinigten Fremdpartikeln der Saugrichtung in den Sammeltank. Die Kontaminierung der Umgebung der Reinigungsposition auf der Oberfläche durch freiwerdende Fremdpartikel wird verhindert. Spanfilter separieren die Fremdpartikel weitgehend.
Die Sammlung von gelösten Öl- und Fettpartikeln sowie sonstigen losen Partikeln
Von der Objektoberfläche gelöste Fremdpartikel müssen aktiv eingefangen werden und anschließend sicher aktiv separiert werden. Falls dies nicht erfolgt, vagabundieren diese zu umliegenden Oberflächen und scheiden sich dort ab. Besondere Gefahr besteht für Menschen. Die Einatmung und die freien Hautflächen scheiden die vagabundierenden Fremdpartikel ab. Die Arbeitsräume im Maschinen- und Anlagenbau sind deshalb mit diversen Rückhalte- und Abscheidern für vagabundierende Fremdpartikel aller Art auszurüsten.
Im Gegensatz zu offenen Lanzen-Kärcher-Systemen, wo die Fremdpartikel in die Umgebung vagabundieren, arbeitet die Trockendampfreinigung als geschlossenes System. Schwaden und Schmutz werden gesammelt.
Das Ladungsverhalten von Wasser und von Dampf – elektrische Leitfähigkeit
Die elektrische Leitfähigkeit ist ein Maß für die Menge der gelösten Ladungen im Wasser. Der Ionengehalt, positive Kationen und negative Anionen, werden quantifiziert. Sind mehr Ionen im Wasser, wird der Strom mit weniger Widerstand fortgeleitet, eine elektrische Leitfähigkeit nach DIN EN 27888. Der Begriff elektrischer Leitwert ist im Wortgebrauch weniger geeignet, er ist der Kehrwert des ohmschen Widerstandes und wird in Siemens angegeben.
Die elektrische Leitfähigkeit ist der Kehrwert des spezifischen elektrischen Widerstandes und wird in S/m (Siemens pro Meter) angegeben.
Destilliertes Wasser hat die Leitfähigkeit den Wert um 0,055µS/cm, die Autoprotolyse des Wassers ist hier die Ursache. Null ist nicht möglich. Die Härtebildner Kalzium und Magnesium als Kationen sowie die Anionen wie Sulfate, Hydrogenkarbonate oder Chloride verringern den elektrischen Widerstand im Wasser. Unbehandeltes Wasser hat diese Bestandteile mehr oder minder, somit ist natürliches Wasser leitend.
Werden im Wasser Anode und Katode montiert, fließt ein elektrischer Strom, bis die Ionenwanderungen beendet sind. Die Temperatur des Wassers beeinflusst die Höhe des Widerstandes der Stromleitung, wachsende Temperatur verringert den Widerstand. Somit müssen die Aussagen zu den Temperaturen in den Messungen auf die Badtemperatur oder auf die Dampftemperatur bezogen werden.
Die quantitative Messung in µS/cm wird nicht nach der Art der gelösten Ionen unterschieden, nur die Menge der Ionen wird gezählt.
Der Leitwert G wird in µS gemessen und ist der reziproke Wert des elektrischen Widerstandes R. Wird dieser Leitwert mit den Zellkonstanten des Messgerätes k=Abstand/Fläche multipliziert ergibt sich die elektrische Leitfähigkeit L =k*G in µS/cm. Viele Messgeräte haben den Wert für k=1, somit wird in der Regel nur vom Leitwert gesprochen.
Wird der Leitwert mit dem Wert 0,65 multipliziert, erhält man die Konzentration der gelösten Feststoffe (TDS=Total Dissolved Solids).
Wenn eine Flüssigkeit den elektrischen Strom leitet, so müssen in dieser Flüssigkeit Ionen vorliegen, durch deren Wanderung der Stromtransport stattfinden kann. Leitfähigkeitsmessungen an reinstem Wasser ergeben eine spezifische Leitfähigkeit von æ(H2O) = 4·10–8 (Ohm)–1 cm–1 (etwa 1/100 des Wertes von gewöhnlichem destilliertem Wasser). Forsetzung auf S. 317
Es müssen also auch in reinstem Wasser Ionen in geringer Konzentration vorliegen. Die Ionen entstehen durch Protonenübertragung von einem Wassermolekül auf ein anderes:

Diesen Vorgang bezeichnet man als Autoprotolyse des Wassers (nach Brönsted). Das Autoprotolysegleichgewicht liegt völlig auf der linken Seite der Gleichung. Eine weitere Protolyse
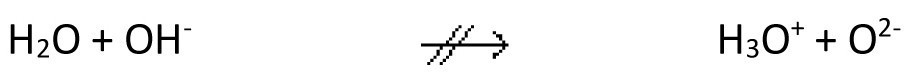
spielt keine Rolle, d. h. freie Oxidionen sind in wäßriger Lösung nicht beständig.
Für [H3O+] > [OH–] reagiert die Lösung sauer, pH < 7
Für [H3O+] = [OH–] reagiert die Lösung neutral, pH = 7
Für [H3O+] < [OH–] reagiert die Lösung basisch, pH > 7
Die elektrische Leitfähigkeit des Wassers und auch die des Dampfes lässt sich durch einen Ionenaustauscher oder durch eine Umkehrosmose-Anlage oder durch Zugabe von Härtebildnern variieren. Das Anlegen einer elektrischen Spannung ändert die Lage des Autoprotolysengleichgewichtes.
Die Gleichgewichtskonstante KW nennt man das Ionenprodukt des Wassers. Ihr Wert hängt von der Temperatur ab; bei 25°C beträgt er 1·10–14 mol2 l–2.
KW= 55*10–14 mol2*L–2 bei 100 °C
Die Temperaturerhöhung des Wassers (Tab. 1) bewirkt das Anwachsen der Gleichgewichtskonstante. Die elektrische Ladung des Wassers/Dampfes in Form der H3O+--Ionen ändert sich. Damit lassen sich saure, neutrale und alkalische wässrige Lösungen wie in Tabelle 2 charakterisieren.
|
T/°C |
KW/mol2l-2 |
|
10 |
0.681 · 10–14 |
|
20 |
0.929 · 10–14 |
|
25 |
1,008 · 10–14 |
|
30 |
1,469 · 10–14 |
|
40 |
2,919 · 10–14 |
|
50 |
5,474 · 10–14 |
|
60 |
9,610 · 10–14 |
|
100 |
55 * 10–14 |
|
sauer |
neutral |
alkalisch |
|
|
c(H3O+) in mol/L |
> 10–7 |
10–7 |
< 10–7 |
|
c(OH–) in mol/L |
< 10–7 |
10–7 |
> 10–7 |
|
pH |
< 7 |
7 |
> 7 |
|
pOH= |
> 7 |
7 |
< 7 |
Wasser bei höheren Temperaturen reagiert sauer. Die Eigenschaft wirkt während der HD-Reinigung. Nach dem Prinzip von Le Chatelier und Braun wird die Energiebilanz berechnet, ob die Autoprotolyse des Wassers exotherm oder endotherm abläuft.
H2O(l) + H2O(l) ↽−−⇀ H3O+(aq )+ OH−(aq)
ΔrHm= [ΔfHm(H3O+) + ΔfHm(OH−)] −
[2·ΔfHm(H2O)]=[(−286,03) + (−230,09)] kJ/mol −
[2·(−286 kJ/mol] = +55,94 kJ
Demnach verläuft die Reaktion endotherm. Nach dem Prinzip von Le Chatelier und Braun fördert eine Temperaturerhöhung die endotherme Hinreaktion, also die Bildung von mehr Oxonium- und Hydroxidionen. Damit ist hier auch eine Steigerung von Kc verbunden, was sich aus dem Massenwirkungsgesetz ergibt. Die Kc ist nur für eine gegebene Temperatur konstant. Mit der Steigerung von Kc geht auch eine Steigerung von KW einher, denn es gilt:
KW=K·c2(H2O)
Mit der beschriebenen Steigerung der Oxoniumionenkonzentration sinkt der pH-Wert, allerdings reagiert das Wasser nicht sauer, da die Oxoniumionenkonzentration und die Hydroxidionenkonzentration immer noch gleich sind. Es lädt sich positiv messbar auf [2].
Wasserhärte prägende Mineralien im Wasser und im Dampf
Die Wasserhärte (water hardness) gibt im Wasser gelösten Ionenkonzentrationen von Calcium und Magnesium an. Je höher der Anteil von Kalzium und Magnesium im Wasser, je höher wird die Wasserhärte, die „Gesamthärte“. Ein deutscher Härtegrad (1 °dH) entspricht 10mg Kalziumoxid oder 7,19 mg Magnesiumoxid pro Liter Wasser.
Warmwasser- und Heizungsanlagen erfordern weiches Wasser, um der Bildung von Kesselstein entgegen zu wirken. Die Dosierung von Waschmitteln ist ebenfalls abhängig von der Wasserhärte, da verschiedene Tenside, insbesondere Lineare Alkylbenzolsulfonate (LAS härteabhängig wirken. Die Härtebildner verringern die Waschkraft von Waschmitteln. Entsprechende Dosiervorschriften müssen auf den Waschmittelpackungen angegeben werden. Seife schäumt in hartem Wasser schlecht, weil sie unlösliche Kalzium- und Magnesiumsalze bildet. Die Auswirkung der Wasserhärte wird deshalb von den meisten Waschmitteln durch Zugabe von Phosphat gemildert. In der Technik erfolgt die Enthärtung u. a. durch:
- Destillation
- Fällung mit Soda oder Natriumphosphat
- mit Ionenaustauscher durch sogenannte Enthärtungsanlagen
- im Haushalt durch die in Wasch- und Reinigungsmitteln eingebauten Enthärtungsmittel.
Der Deutsche Bundestag hat am 1. Februar 2007 die Neufassung des Gesetzes über die Umweltverträglichkeit von Wasch- und Reinigungsmitteln (Wasch-und Reinigungsmittelgesetz – WRMG) beschlossen. Die Neufassung ist am 5. Mai 2007 in Kraft getreten (siehe Bundesgesetzblatt Teil 1 vom 4. Mai 2007, S. 600).
Nach § 9 des Gesetzes sind die Wasserversorgungsunternehmen verpflichtet, dem Verbraucher die Härtebereiche des Trinkwassers wie folgt anzugeben:
- Härtebereich weich: weniger als 1,5 mmol Kalziumcarbonat je Liter (entspricht 8,4 °dH)
- Härtebereich mittel: 1,5 bis 2,5 mmol Kalziumcarbonat je Liter (entspricht 8,4 °dH bis 14 °dH)
- Härtebereich hart: mehr als 2, 5 mmol Kalziumcarbonat je Liter (entspricht mehr als 14 °dH)
Diese neuen drei Härtebereiche lösen die alten vier Bereiche ab. Die Angaben müssen in Millimol (mmol) Kalziumcarbonat pro Liter erfolgen (was für Härteangaben international gebräuchlich ist). Es wird davon ausgegangen, dass weiterhin die Gesamthärte (Summe der Konzentrationen von Kalzium und Magnesium, berechnet als Kalziumcarbonat) anzugeben ist. Das Gesetz macht hierzu allerdings keine Aussage.
Die neuen Härtebereiche beruhen auf europäischem Recht; die EG-Detergenzien-Verordnung verpflichtet die Waschmittelhersteller zur Angabe von Dosierempfehlungen für diese drei Härtebereiche. Wie in Frankreich, in England und in der BRD unterschiedliche Definitionen für die Wasserhärte zur Anwendung kamen, wurde im Zuge einer EG-weiten Vereinheitlichung dieser Begriff neu gefasst und nur noch auf den Gehalt der Kalzium- und Magnesiumionen bezogen.
Unter der Wasserhärte versteht man die Stoffmengenkonzentration der Ca2+ - und Mg2+- Ionen c(Ca2+ + Mg2+) in mmol pro Liter (DIN 38409-H 6).
Im Allgemeinen besteht die Gesamthärte zu 70–85 % aus der Kalzium- und entsprechend zu 30–15 % aus der Magnesiumhärte. Eine sehr verbreitete und häufig angewendete Unterteilung der Wasserhärte, die sowohl in der Wasserwirtschaft als auch im Bauwesen nach wie vor eine wichtige Rolle spielt, orientiert sich an den vorhandenen Anionen. Man unterscheidet zwischen der Karbonat- und der Nicht-Karbonathärte.
Karbonathärte (temporäre Härte): Die Karbonathärte (KH) ist jener Anteil an Kalzium- und Magnesiumionen, für den in der Volumeneinheit eine äquivalente Konzentration an Hydrogen-Karbonisation vorliegt. Die KH ist durch Kochen entfernbar.
Ca2+ + Mg2+ + 4 HCO₃ − → CaCO₃ ↓ + MgCO₃ ↓ + 2 H₂O + 2 CO₂<1>
Nicht-Karbonathärte (permanente Härte oder Resthärte): Die Nicht-Karbonathärte (NKH ) ist der nach Abzug der KH von der Gesamthärte gegebenenfalls verbleibende Rest an Ca2+ - und Mg2+-Ionen, der vor allem aus der Auflösung von Sulfaten (z. B. aus CaSO₄) und Chloriden (z. B. CaCl₂) stammt. Die NKH lässt sich nicht durch Kochen entfernen. Die Bestimmung der Wasserhärte gehört zu den häufigsten Routinebestimmungen sowohl im analytischen als auch im technischen Bereich. In Deutschland wird die Wasserhärte oft noch in Grad deutscher Härte °dH bzw. °d angegeben.
Es gilt: 1 °dH = 10 mg CaO (bzw. 7,14 mg MgO) in 1 Liter Wasser.
Die Problematik dieser Festlegung besteht darin, dass die Konzentration an Härtebildnern auf den Gehalt an CaO zurückgeführt wird, obwohl diese Verbindung überhaupt kein Wasserinhaltsstoff ist.
Soll also für eine konkrete Problemstellung die Härte des Wassers bestimmt und DIN-gerecht angegeben werden, so kommt nur die Stoffmengenkonzentration der Härtebildner (berechnet als Calcium) in mmol pro Liter in Betracht. Da diese Größe häufig nicht anschaulich genug ist, sollte die Angabe °dH zusätzlich erfolgen.
Nach der geforderten Angabe der Wasserhärte in mmol/l (1 mmol (Ca2+ + Mg2+)/l = 5,6 °dH) ergeben sich folgende Härtebereiche: Härtebereich c(Ca2+ + Mg2+) /l H2O °dH
1 (weich) < 1,3 mmol < 7
2 (mittelhart) 1,3–2,5 mmol 7 - 14
3 (hart) 2,5–3,8 mmol 14–21
4 (sehr hart) > 3,8 mmol > 21
Da in der Regel die Menge an Mg2+ im Vergleich zur Ca2+-Konzentration im Wasser klein ist und beide Kationen analytisch zusammen bestimmt werden, wird der Gehalt an Magnesium üblicherweise nicht gesondert ausgewiesen, sondern dem Gehalt an Ca2+ zugerechnet.
In Teil 9 folgt die Übersicht der Versuche und Versuchsergebnisse sowie technologische Parameter für eine erfolgreiche Oberflächenreinigung
Literatur
[1] http://groups.uni-paderborn.de/cc/lehrveranstaltungen/_aac/vorles/skript/ kap_10/kap10_2.html, Prof. Dr. Gernot Reininger and Prof. Dr. Volker Schubert, University of Paderborn
[2] www.jagemann-net.de/massenwirkungsgesetz/massenwirkungsgesetz.php
M. Jakob; S. Erk: Der Wärmeübergang beim Kondensieren von Heiß- und Sattdampf, Mitteilungen aus der Physikalisch-technischen Reichsanstalt, Heft 310, H4, VDI-Verlag Berlin, 1928




