La corrosión agresiva a alta temperatura, el polvo metálico, se produce en atmósferas reductoras, como las que se encuentran en las plantas de producción de hidrógeno. Dado que las condiciones de proceso son cada vez más extremas para lograr una mayor eficiencia, es necesario desarrollar materiales con mayor resistencia al polvo metálico para los componentes estructurales de los sistemas. Los revestimientos también desempeñan un papel en este sentido.
Los desarrolladores de aleaciones se enfrentan al reto de incorporar al material altas proporciones de formadores de óxido. El cobre puede utilizarse cada vez más como elemento de aleación en el futuro, ya que se considera que inhibe el ataque catalítico. Esto abre nuevas opciones para el desarrollo de aleaciones innovadoras.
¿Qué es el polvo metálico?
La cuestión de la corrosión a alta temperatura en metales estructurales no suele reconocerse como un tema moderno. Tradicionalmente, el polvo metálico se conoce sobre todo en la industria química y petroquímica, por ejemplo, en procesos como la pirólisis, el craqueo al vapor, el reformado al vapor, la oxidación parcial, la producción de amoníaco, urea y ácido nítrico, las coquerías y la producción y procesamiento de gas de síntesis. Las atmósferas típicas de estas plantas provocan una forma especialmente agresiva de corrosión a alta temperatura, conocida como "metal dusting". El polvo metálico se produce en entornos con temperaturas de entre 400 y 900 °C aproximadamente, con un máximo en torno a los 600 °C, y a menudo provoca daños espontáneos en los componentes. Aunque muchos procesos, como la producción de coque, tienen lugar a temperaturas por encima del intervalo crítico de ataque del polvo metálico, las temperaturas más bajas en la periferia aguas abajo (zona descendente) provocan daños localizados en ella. Normalmente, las atmósferas de proceso de dichos procesos están formadas por una elevada proporción de CO y H2, además de otras moléculas comoCO2, N2, alcoholes y vapor de agua, por lo que los procesos están asociados a elevados requisitos de material, por ejemplo, para reactores y tuberías metálicas.
![Abb. 1: Metallische Proben vor und nach einer Auslagerung unter Metal-Dusting-Bedingungen. a) Monel Alloy 400 zeigt einen flächigen Angriff [1], und bei b) wird der Angriff der HR-235-Legierung in Form von Pit-Bildung sichtbar [2]](/images/stories/Abo-2023-06/thumbnails/thumb_gt-2023-06-041.jpg) Fig. 1: Muestras metálicas antes y después del envejecimiento en condiciones de polvo metálico. a) La aleación Monel 400 muestra un ataque superficial [1], y en b) el ataque de la aleación HR-235 es visible en forma de formación de picaduras [2].
Fig. 1: Muestras metálicas antes y después del envejecimiento en condiciones de polvo metálico. a) La aleación Monel 400 muestra un ataque superficial [1], y en b) el ataque de la aleación HR-235 es visible en forma de formación de picaduras [2].
Uno de los mayores retos para la industria es que el ataque por polvo metálico suele producirse tras un periodo de incubación difícil de predecir [3, 4]. El ataque por polvo metálico describe el proceso en el que los materiales metálicos son atacados desde la superficie por la incorporación de carbono al material. El producto de la corrosión es de color negro (Fig. 1a) y se denomina "coque". Está formado por finas partículas metálicas, grafito, carbono amorfo y finas partículas de óxido [5]. Todos los elementos base comunes de las aleaciones de alta temperatura - hierro (Fe), níquel (Ni) y cobalto (Co) - son, en determinadas condiciones, susceptibles al polvo metálico e incluso catalizan el ataque. En la mayoría de los casos, el ataque se produce localmente en las denominadas "picaduras" (Fig. 1b). Tres reacciones son decisivas para la separación del C de la fase gaseosa.
Reacción del gas de síntesis: CO(g) + H2(g)→C(s) + H2O(g) <1>
Reacción de Boudouard: 2 CO(g) → C(s) +CO2(g)<2>
Escisión del metano: CH4(g) → C(s) + 2H 2(g)<3>
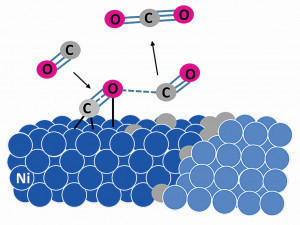 Fig. 2: Representación esquemática del mecanismo de desprendimiento de polvo metálico desde la descomposición de la molécula que contiene carbono (en este caso CO) hasta la difusión del carbono en la superficie metálica y la acumulación en un límite de grano.
Fig. 2: Representación esquemática del mecanismo de desprendimiento de polvo metálico desde la descomposición de la molécula que contiene carbono (en este caso CO) hasta la difusión del carbono en la superficie metálica y la acumulación en un límite de grano.
4 pasos describen el mecanismo (Fig. 2) [6]:
- Los gases que contienen C (por ejemplo, CO o CxH2x+2) se adsorben y descomponen catalíticamente en la superficie de la aleación.
- El enlace entre el C y la superficie metálica es débil, por lo que los átomos de C pueden difundirse en la matriz metálica a lo largo de vías de difusión fáciles (grietas, bordes, límites de grano). En las aleaciones con base de níquel, el C se disuelve en el material y se forman precipitados de carburo (normalmente carburos de cromo).
- En cuanto el C se acumula en el material, el grafito cristaliza en la zona de defectos de red, como los límites de grano y de fase.
- El aumento de volumen debido a la formación de grafito provoca fuertes tensiones que hacen que el material metálico se desprenda desde el interior.
¿Por qué es relevante el polvo metálico para la transición energética?
Debido a la crisis energética, los procesos de producción y almacenamiento de hidrógeno (H2) han experimentado un nuevo auge. Las atmósferas, a menudo reductoras y ricas en carbono, en combinación con las altas temperaturas crean una nueva relevancia para la forma de corrosión a alta temperatura del polvo metálico, especialmente en el contexto de la producción de hidrógeno. Según la teoría del color del hidrógeno de Kalis [7], los siguientes materiales de partida y procesos de producción se ven afectados por el polvo metálico:
- Electrólisis a alta temperatura (H2 verde)
- Pirólisis de metano (H2 turquesa)
- Gasificación de biomasa (H2 amarillo)
- Reformado de vapor concaptura y almacenamiento deCO2(CAC) y combinaciones de combustibles fósiles con CAC (H2 azul)
- Reformado con vapor, oxidación parcial, reformado autotérmico a partir de gas natural sin CAC (H2 gris)
- Gasificación del carbón a partir del lignito (H2 marrón)
- Gasificación del carbón a partir de hulla (H2 negro).
Está claro que la mayoría de los procesos de producción de hidrógeno se ven afectados por el polvo metálico. Esto se aplica tanto a los procesos que utilizan combustibles fósiles como a los que se basan en fuentes renovables.
En la actualidad, alrededor del 95 % del hidrógeno que se produce en el mundo se obtiene mediante reformado con vapor (proceso SMR), en el que el gas fósil, principalmente gas natural, se quema para obtener CO y H2 (gas de síntesis) [8]. La reacción química correspondiente de la producción de gas de síntesis a partir de metano es
CH4(g) + H2O(g) → CO(g) + 3H2(g)
Los procesos que se están considerando para la producción de H2 ecológico y en los que existe el riesgo de fallo del material debido al polvo metálico son la electrólisis a alta temperatura y el reformado con vapor a partir de alcoholes producidos regenerativamente [9, 10]. En la coelectrolisis de alta temperatura se produce gas de síntesis (H2 y CO) a partir de agua,CO2 y electricidad. El objetivo del reformado con vapor a partir de alcoholes es producir los alcoholes utilizados a partir de biomasa de forma regenerativa.
¿Por qué es importante en nuestra vida cotidiana?
El hidrógeno y, por tanto, su producción es de crucial importancia debido a su potencial como vector energético del futuro, pero también como material de partida para muchos procesos de la industria química y petroquímica, con cuyos productos entramos en contacto a diario (por ejemplo, fertilizantes, cosméticos, productos farmacéuticos, polímeros, tintes, detergentes, química fina). El proceso Haber-Bosch, que pasó a la historia con el eslogan "pan del aire" y se utiliza para sintetizar amoníaco, también depende del suministro de hidrógeno. Además de los procesos para la producción de hidrógeno, en muchos procesos también se necesita CO (producción de gas de síntesis) oCO2 (oxidación de CO) como materia prima. Los procesos de producción de estas materias primas gaseosas son los mismos que los enumerados anteriormente para la producción de H2 solo. Por consiguiente, estos procesos también provocan fallos en los materiales debido al polvo metálico.
Según un estudio reciente de DECHEMA e. V., suponiendo el mejor escenario posible, en 2030 se seguirá necesitando al menos un 87% de combustibles fósiles para la producción de ácido nítrico (proceso de Ostwald) y un 92% para la producción de urea [11]. Dado que la producción de urea, por ejemplo, requiereCO2 además de H2, el objetivo en este ámbito no es necesariamente hacer funcionar el proceso sinproducir CO2. Más bien, debería utilizarse un control innovador del proceso para utilizar elCO2 producido durante la producción de gas de síntesis en la síntesis de educto, haciendo así que el proceso sea neutro para el clima. Esto demuestra que la utilización de combustibles fósiles sigue siendo conveniente en algunos ámbitos siel CO2 puede reutilizarse directamente adaptando el control del proceso. Por ello, en estos procesos también se conservan las atmósferas que provocan el polvo metálico.
Tendencias en el desarrollo de aleaciones para entornos con polvo metálico
Para que los procesos sean cada vez más eficientes, las condiciones de proceso son cada vez más agresivas (cambios de temperatura más rápidos, atmósferas más agresivas, presiones más elevadas) y, por tanto, suponen un reto cada vez mayor para la estabilidad de los materiales utilizados frente a la corrosión a altas temperaturas. Por lo tanto, en tiempos de transición energética, la relevancia de este ataque, que aún no se conoce del todo para los materiales estructurales, es enorme y no perderá importancia en el futuro. El desarrollo selectivo de materiales resistentes al polvo metálico para nuevas aplicaciones, así como de materiales más resistentes para conservar los recursos y evitar el fallo de los materiales, será aún más atractivo en el futuro. Existen dos enfoques para el desarrollo de aleaciones:
- Aleación con formadores de óxido que forman una capa de óxido como barrera entre la atmósfera agresiva y el sustrato metálico (véase la Fig. 3 a).
- Aleación con elementos que inhiben catalíticamente la disociación de las moléculas que contienen carbono (representado esquemáticamente en la Fig. 3 b).
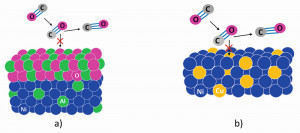 Fig. 3: Representación esquemática de ambos conceptos de aleación para aumentar la resistencia al polvo metálico: a) una barrera oxídica y b) aleación con cobre para inhibir la deposición de carbono.
Fig. 3: Representación esquemática de ambos conceptos de aleación para aumentar la resistencia al polvo metálico: a) una barrera oxídica y b) aleación con cobre para inhibir la deposición de carbono.
Aleación con formadores de óxido
En los procesos con atmósferas de polvo metálico, se suelen utilizar aleaciones a base de Fe y Ni con altos contenidos de Al y Cr. Estos materiales suelen formar capas protectoras de Cr2O3, Cr2MnO4 o Al2O3. Si la capa protectora de óxido falla localmente y no es posible formar una nueva, el componente se ve atacado en este punto por daños de muy rápido crecimiento en forma de picaduras. Es importante que los elementos formadores de óxido formen capas de óxido protectoras y estables incluso a bajas presiones parciales de oxígeno: el polvo metálico se produce en entornos reductores con p(O2) < 10-15 Pa.
Dado que el mecanismo exacto del polvo metálico no se conoce del todo, los factores que influyen en él no están aún del todo claros y la selección de aleaciones y su posterior desarrollo están asociados a un cierto grado de incertidumbre. Por ejemplo, no está claro qué efecto tienen la composición exacta del gas y la presión del proceso [12, 13]. Como regla general, la proporción de formadores de óxido y, en particular, de cromo en la aleación puede utilizarse como medida de la resistencia de la aleación al polvo metálico; cuanto mayor sea el contenido de Cr, mejor será la resistencia. Sin embargo, niveles muy elevados de formadores de óxido tienen un efecto negativo en la trabajabilidad y mecanizabilidad de la aleación, por ejemplo, aumenta la fragilidad. La formación de fases frágiles también aumenta con el incremento del contenido de Cr, mientras que la resistencia al impacto y la soldabilidad disminuyen. Para conseguir un equilibrio en la composición entre la resistencia a la corrosión y las propiedades mecánicas, es importante poder determinar las proporciones exactas de formadores de óxido (y otros elementos que influyen en la formación de la capa protectora de óxido) que conducen a la resistencia del material. Desde 1972, existen diversos enfoques para calcular el denominado equivalente de Cr (Cräqu) con este fin:
- Cräq = Cr (en % en peso) + 2 -Si (en % en peso) > 22 % en peso [14]
- Cräq = Cr (en % en peso) + 2 -Si (en % en peso) > 24 % en peso [15]
- Cräq = Cr (en % en peso) + 3 - (Si + Al) (en % en peso) >
24 % en peso [16] - Cr > 28 % en peso en aleaciones a base de Ni independientemente del Al (el alto contenido de Al reduce la acumulación de carbono en la superficie) [17]
- Cr (en % en peso) + Al (en % en peso) > 33 % en peso [18, 19]
- Bajo contenido de Fe en la aleación de Ni [20,21]
- Cr ≥ 29,5 % en peso, Al ≥ 2,0 % en peso de Al, Fe = 2,7-4,2 % en peso (las variaciones en el contenido de Cr entre 28,9-29,4 % en peso tienen una gran influencia) [22].
Esta lista sugiere que la complejidad de una estimación de este tipo es mucho mayor de lo que puede representar una simple suma de las proporciones ponderadas de los formadores de óxido típicos (Al, Si, Cr). Elementos como el hierro o el manganeso también influyen en la resistencia del material.
Aleación con elementos inhibidores
Se ha demostrado que elementos como el estaño (Sn), el cobre (Cu) y el germanio (Ge) reducen el ataque del óxido metálico. La teoría es que estos elementos tienen un efecto catalítico inhibidor o al menos neutro sobre la adhesión y disociación de las moléculas que contienen carbono (véase la Fig. 3b) [23-25]. Dado que los límites de fase constituyen una vía de difusión fácil, es importante evitar su formación; la formación de fases intermetálicas y los límites de fase resultantes aumentan la susceptibilidad a los ataques de polvo metálico [26-29]. Por ello, el Ge y el Sn se aplican a la superficie mediante recubrimientos [30-32]. Debido a la alta solubilidad del cobre en la matriz de níquel, el Cu es el único de los tres elementos mencionados que se considera como elemento de aleación para mejorar la resistencia al metalusting.
En estudios anteriores, se planteó la hipótesis de que un contenido de Cu de al menos el 10% en peso (en acero inoxidable) [33] o del 20% en peso en aleaciones binarias Ni-Cu conduce a una inhibición completa del ataque por corrosión metálica [34, 35]. Esto se ha refutado recientemente en experimentos con aleaciones binarias Ni-Cu monofásicas (carbono cúbico centrado en la cara) [36]. Las imágenes correspondientes que muestran el ataque del carbono pueden verse en la Figura 4. Aunque el valor límite exacto y su influencia por otros elementos de aleación aún no están claros, se ha demostrado que contenidos de Cu de alrededor del 10 % en peso conducen a una mejora considerable de la resistencia al óxido metálico.
![Abb. 4: Makrobilder (links) und entsprechende Querschliffe (rechts) der Werkstoffe Monel Alloy 400 und der Modelllegierung Ni-32Cu während einer Auslagerung bei 620 °C in 20 % CO – 20 % H2 – 1 % H2O – 8 % CO2 – 51 % Ar bei 18 bar für 961 h [36] gt 2023 06 046](/images/stories/Abo-2023-06/thumbnails/thumb_gt-2023-06-041.jpg) Fig. 4: Macroimágenes (izquierda) y secciones transversales correspondientes (derecha) de los materiales Monel Alloy 400 y la aleación modelo Ni-32Cu durante el envejecimiento a 620 °C en 20 % CO - 20 % H2 - 1 % H2O - 8 % CO2 - 51 % Ar a 18 bar durante 961 h [36].
Fig. 4: Macroimágenes (izquierda) y secciones transversales correspondientes (derecha) de los materiales Monel Alloy 400 y la aleación modelo Ni-32Cu durante el envejecimiento a 620 °C en 20 % CO - 20 % H2 - 1 % H2O - 8 % CO2 - 51 % Ar a 18 bar durante 961 h [36].
Ya se está intentando utilizar el efecto del Cu con las últimas aleaciones disponibles en el mercado de diversos fabricantes: La aleación con base de níquel NSSMC 696 de Nippon Steel contiene 2,1 % en peso de Cu además de 30 % en peso de Cr, la aleación HR-235 de Haynes contiene incluso 31 % en peso de Cr y 3,8 % en peso de Cu [37]. Sin embargo, estas aleaciones contienen sólo pequeñas cantidades de Cu y también altas cantidades de formadores de óxido. El Cu también está destinado a aumentar la protección en caso de fallo de la capa de óxido o al principio de una exposición, cuando todavía no se ha formado ninguna capa protectora de óxido. El diseño de futuras aleaciones se centra ahora en la combinación de mayores proporciones de cobre -o incluso de otro elemento de aleación con efecto inhibidor- con elevadas proporciones de formadores de óxido, pero sin que se produzca un aumento de la precipitación de fases. La investigación y el desarrollo en la industria tendrán que hacer frente a este reto en el futuro.
Bibliografía
[1] Schmitt, F.: Investigations of the metal dusting resistance of additive manufactured Ni-based alloys as a function of surface treatments, Tesis de máster, TH Bingen, Frankfurt, 2021.
[2]Ulrich, A.S.; Schmitt, F.; Reiff, L.; Jahns, K.; Krupp, U.; Galetz, M.C.: The Effect of Surface Finish on Metal Dusting, conferencia EUROCORR 2021, digital, 21 de septiembre de 2021
[3]Natesan, K.; Zeng, Z.: Development of Materials Resistant to Metal Dusting Degradation, Argonne National Lab.(ANL), Argonne, IL (USA), Informe final, 2007
[4]Fabas, A.; Monceau, D.; Josse, C.; Lamesle, P.; Put, A.R.-V.: Mechanism of Metal Dusting Corrosion by Pitting of a Chromia-Forming Alloy at Atmospheric Pressure and Low Gas Velocity, Corros. Sci., 107, 2016, 204-210, https://doi.org/10.1016/j.corsci.2016.02.033
[5]Szakalos, P.; Lundberg, M.; Pettersson, R.: Metal Dusting on an Alumina Forming Ni-Base Alloy, Corros. Sci, 48 (7), 2006, 1679-1695, https://doi.org/10.1016/j.corsci.2005.05.023
[6]Young, D.J.; Zhang, J.; Geers, C.; Schütze, M.. Recent Advances in Understanding Metal Dusting: A Review, Mater. Corros, 62 (1), 2011, 7-28, https://doi.org/10.1002/maco.201005675
[7]Kalis, M.: Hydrogen - We need a colour theory and a detection system for green hydrogen, https://www.erneuerbare-energien-hamburg.de/de/blog/details/wasserstoff-wir-brauchen-eine-farbenlehre-und-ein-nachweissystem-fuer-gruenen-wasserstoff.html, abril de 2023
[8]Brun, K.; Allison, T.C.: Machinery and Energy Systems for the Hydrogen Economy, Elsevier, 2022
[9]Mattos, L.V.; Jacobs, G.; Davis, B.H.; Noronha, F.B.: Production of Hydrogen from Ethanol: Review of Reaction Mechanism and Catalyst Deactivation, Chem. Rev., 112 (7), 2012, 4094-4123, https://doi.org/10.1021/cr2000114
[10]Zurek, J.; Margaritis, N.; Naumenko, D.; Menzler, N.H.; Quadakkers, W.J.: Behaviour of Metallic Materials in Simulated Service Environments of CO2/H2O Co-Electrolysis Systems for Power-to-X Application, Oxid. Met., 92, 2019, 353-377, https://doi.org/10.1007/s11085-019-09927-9
[11]Ausfelder, F.; Herrmann, E.O.; González, L.F.L.: Perspective Europe 2030: Technology Options for CO2-Emission Reduction of Hydrogen Feedstock in Ammonia Production, DECHEMA Gesellschaft für Chemische Technik und Biotechnologie e.V., 2022
[12]Madloch, S.; Dorcheh, A.S.; Galetz, M.C.: Effect of Pressure on Metal Dusting Initiation on Alloy 800H and Alloy 600 in CO-Rich Syngas, Oxid. Met. 2018, 89, 483-498, https://doi.org/10.1007/s11085-017-9801-x
[13]Schlereth, C.; Hack, K.; Galetz, M.C.: Parameters to Estimate the Metal Dusting Attack in Different Gases, Corros. Sci, 206, 2022, 110483, https://doi.org/10.1016/j.corsci.2022.110483.
[14]Schueler, R.C.: Metal Dusting. Hydrocarb. Process, 51 (8), 1972, 73
[15]Schillmoller, C.M.: Solving High-Temperature Problems in Oil Refineries and Petrochemical Plants, Solving High-Temp. Probl. Oil Refineries, Petrochem Plants, 93 (1), 1986, 83-87
[16]Parks, S.B.; Schillmoller, C.M.: Improve Alloy Selection for Ammonia Furnaces, Hydrocarb. Process, 76 (10), 1997
[17]Röhnert, D.; Schütze, M.; Weber, T.: Performance of Several Nickel Base Alloys in Metal Dusting Atmospheres, En CORROSION 2007, OnePetro, 2007
[18]Hermse, C.; van Wortel, H.: Applicability Of Coatings To Control Metal Dusting, OnePetro, 2009
[19]Hermse, C.G.M.; van Wortel, J.C.: Metal Dusting: Relationship between Alloy Composition and Degradation Rate, Corros. Eng. Sci. Technol., 44 (3), 2009, 182-185, https://doi.org/10.1179/174327809X419140
[20]Hattendorf, H.; Hermse, C.G.M.; IJzerman, R.M.: The Influence of Alloying Elements on Metal Dusting Behaviour of Nickel Chromium Alloys and Their Statistical Correlation, Mater. Corros, 70 (8), 2019, 1385-1399, https://doi.org/10.1002/maco.201810593
[21]Li, B.; Gleeson, B.; Chen, W.-T.; Hattendorf, H.: Effects of Minor Alloying Elements on the Metal-Dusting Behaviour of Ni-Based Alloys, En CORROSION 2020, OnePetro, 2020.
[22]Schlereth, C.; Oskay, C.; Hattendorf, H.; Nowak, B.; Galetz, M.C.: Influence of Al and Fe Additions on Metal Dusting of NiCr Alloys, Mater. Corros, 73 (9), 2022, 1346-1358, https://doi.org/10.1002/maco.202112935.
[23]Oden, L.L.; Gokcen, N.A.: Sn-C and Al-Sn-C Phase Diagrams and Thermodynamic Properties of C in the Alloys: 1550 °C to 2300 °C, Metall. Trans. B, 24, 1993, 53-58
[24]Trimm, D.L.: Catalysts for the Control of Coking during Steam Reforming, Catal. Today, 49 (1-3), 1999, 3-10, https://doi.org/10.1016/S0920-5861(98)00401-5
[25]Nikolla, E.; Holewinski, A.; Schwank, J.; Linic, S.: Controlling Carbon Surface Chemistry by Alloying: Carbon Tolerant Reforming Catalyst, J. Am. Chem. Soc. 2006, 128 (35), 11354-11355, https://doi.org/10.1021/ja0638298
[26]Chun, C.M.; Mumford, J.D.; Ramanarayanan, T.A.: Carbon-Induced Corrosion of Nickel Anode, J. Electrochem. Soc. 2000, 147 (10), 3680, https://doi.org/3680. 10.1149/1.1393958
[27]Zhang, J.; Young, D.J.: Kinetics and Mechanisms of Nickel Metal Dusting I. Kinetics and Morphology, Corros. Sci. 2007, 49 (3), 1496-1512, https://doi.org/10.1016/j.corsci.2006.08.008
[28]Zhang, J.; Young, D. J.: Coking and Dusting of Fe-Ni Alloys in CO-H2-H2O Gas Mixtures, Oxid. Met., 70, 2008, 189-211, https://doi.org/10.1007/s11085-008-9115-0
[29]Galetz, M.C.; Schlereth, C.; White, E.M.: Behaviour of Copper-Containing High-Entropy Alloys in Harsh Metal-Dusting Environments, Mater. Corros, 72 (7), 2021, 1232-1242, https://doi.org/10.1002/maco.202012075
[30]Geers, C.; Galetz, M.; Schütze, M.: Investigation of the Effect of the Alloy 600 Substrate for the Stability of a Ni3Sn2 Coating for Metal Dusting Protection at 620 °C, Surf. Coat. Technol., 215, 2013, 2-6, https://doi.org/10.1016/j.surfcoat.2012.04.100
[31]Madloch, S.; Galetz, M.C.; Geers, C.; Schütze, M.: Development of a Metal Dusting Resistant Functional Coating by Sn and Al Pack Cementation, Surf. Coat. Technol., 299, 2016, 29-36, https://doi.org/10.1016/j.surfcoat.2016.04.067
[32]Galetz, M.C.; Oskay, C.; Madloch, S.: Microstructural Degradation and Interdiffusion Behaviour of NiAl and Ge-Modified NiAl Coatings Deposited on Alloy 602 CA, Surf. Coat. Technol., 2019, 364, 211-217, https://doi.org/10.1016/j.surfcoat.2019.02.048
[33]Zhang, J.; Young, D.J.: Effect of Copper on Metal Dusting of Austenitic Stainless Steels, Corros. Sci, 49 (3), 2007, 1450-1467, https://doi.org/10.1016/j.corsci.2006.06.032.
[34]Nishiyama, Y.; Moriguchi, K.; Otsuka, N.; Kudo, T.: Improving Metal Dusting Resistance of Transition-Metals and Ni-Cu Alloys, Mater. Corros., 56 (11), 2005, 806-813, https://doi.org/10.1002/maco.200503883
[35]Chun, C.; Desai, S.; Ramanarayanan, T.A.: Metal Dusting Resistant Copper-Based Materials, Corrosion, 68 (9), 2012, 810-821, https://doi.org/10.5006/0609
[36]Jahns, K.; Ulrich, A.S.; Schlereth, C.; Reiff, L.; Krupp, U.; Galetz, M.C.: The Effect of Cu Content and Surface Finish on the Metal Dusting Resistance of Additively Manufactured NiCu Alloys, Oxid. Met., 96, 2021, 241-256, https://doi.org/10.1007/s11085-021-10037-8
[37]Li, B.; Deodeshmukh, V.; Schlereth, C.; Ulrich, A.S.; Galetz, M.C.: Metal Dusting Resistance of N06235 Alloy and Its Weld Overlay Under High Pressure Condition, In AMPP Annual Conference+ Expo, OnePetro, 2022





