1 Die Geschichte eines Edelmetalls
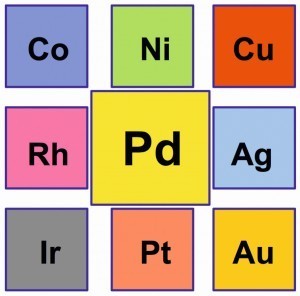 Abb. 1: Palladium und seine Nachbarn im PSEDer englische Arzt und Chemiker William Hyde Wollaston (1766–1828) entdeckte 1802 das neue Element in einem südamerikanischen Platin-Erz, nachdem er Platin, das der spanische Gelehrte und Admiral Antonio de Ulloa bereits 1748 beschrieb [1], in Königswasser auflöste und als Ammonium-Hexachloridoplatinat(IV) ausfällte, in der verbleibenden Mutterlauge als reines Metall. Das geschah im Alkalischen mit Quecksilbercyanid, Hg(CN)2, und anschließendem Kalzinieren.
Abb. 1: Palladium und seine Nachbarn im PSEDer englische Arzt und Chemiker William Hyde Wollaston (1766–1828) entdeckte 1802 das neue Element in einem südamerikanischen Platin-Erz, nachdem er Platin, das der spanische Gelehrte und Admiral Antonio de Ulloa bereits 1748 beschrieb [1], in Königswasser auflöste und als Ammonium-Hexachloridoplatinat(IV) ausfällte, in der verbleibenden Mutterlauge als reines Metall. Das geschah im Alkalischen mit Quecksilbercyanid, Hg(CN)2, und anschließendem Kalzinieren.
Da 1802 der Bremer Astronom und Arzt Heinrich Wilhelm Olbers kurz zuvor einen neuen Planetoiden im Asteroiden-Gürtel entdeckt hatte [2] und ihn nach der griechischen Göttin „Pallas Athene“ mit „Pallas“ benannte, schlug Wollaston für sein neues Element „Palladium“ vor [3].
Bereits 1866 bemerkte Thomas Graham (1805–1869) die erstaunliche Speicherfähigkeit des feinverteilten Palladiums für Wasserstoff, das bei Raumtemperatur und Atmosphärendruck etwa das 900fache seines eigenen Volumens an Wasserstoffgas aufnehmen kann [4].
Im Jahr 1894 entdeckte der amerikanische Chemiker Francis Clifford Phillips (1850–1920) die stöchiometrische Oxidation von Ethen, H2C=CH2, zu Acetaldehyd, H3C-CH=O, in Gegenwart von Palladium(II)-chlorid, PdCl2, als er die Oxidation natürlich vorkommender Kohlenwasserstoffe untersuchte [5]. Ein Verfahren, mit dem die Wacker-Chemie später eine Million Jahrestonnen Acetaldehyd mit dem Folgeprodukt Essigsäure, CH3COOH, herstellte.
2 Chemische und physikalische Eigenschaften
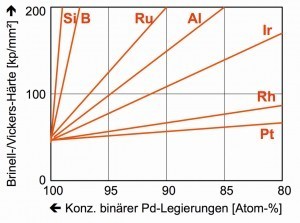 Abb. 2: Härte-Verlauf legierter Palladium-LegierungenPalladium mit der Ordnungszahl 46 besteht aus sechs stabilen Isotopen, die zusammen das Atomgewicht 106,42 ergeben. Im Periodensystem der Elemente steht es oberhalb der „Schweren Platingruppenmetalle“ Iridium und Platin mit den Dichten 22,56 und 21,45 g/cm3 (20 °C) sowie Gold mit einer Dichte von 19,32 g/cm3. Die Elemente Rhodium und Silber flankieren das Palladium. Mit dem Rhodium zählt das Palladium zu den „Leichten Platingruppenmetallen“ mit den Dichten von 12,38 und 11,99 g/cm3. Die Dichte des Silbers liegt mit 10,49 g/cm3 auf annähernd gleichem Niveau. Oberhalb des Palladiums platzieren sich die unedlen Übergangsmetalle Kobalt, Nickel und Kupfer (Abb. 1).
Abb. 2: Härte-Verlauf legierter Palladium-LegierungenPalladium mit der Ordnungszahl 46 besteht aus sechs stabilen Isotopen, die zusammen das Atomgewicht 106,42 ergeben. Im Periodensystem der Elemente steht es oberhalb der „Schweren Platingruppenmetalle“ Iridium und Platin mit den Dichten 22,56 und 21,45 g/cm3 (20 °C) sowie Gold mit einer Dichte von 19,32 g/cm3. Die Elemente Rhodium und Silber flankieren das Palladium. Mit dem Rhodium zählt das Palladium zu den „Leichten Platingruppenmetallen“ mit den Dichten von 12,38 und 11,99 g/cm3. Die Dichte des Silbers liegt mit 10,49 g/cm3 auf annähernd gleichem Niveau. Oberhalb des Palladiums platzieren sich die unedlen Übergangsmetalle Kobalt, Nickel und Kupfer (Abb. 1).
Aus der Nähe zum Platin resultieren die gleichen üblichen Oxidationsstufen von +2 und +4. Mit einer Mohs-Härte von nur 4,75, also vergleichbar mit einer Muschelschale, erscheint reines Palladium relativ weich. Die Härte des Palladiums wächst rapide an, wenn bereits geringe Fremdmetall-Mengen zulegiert werden (Abb. 2). Ein Effekt, der für die technischen Anwendungen sehr bedeutsam ist [6].
Auf die hohe Wasserstoff-Aufnahme von nanoskaligem Palladium-Pulver sei besonders aufmerksam gemacht: H2 kann bis zum 3.000-fachen Volumen in das Metallgitter eingelagert werden (Abb. 3).
Erhitzte Rohre aus Palladium sind mit einem Sieb vergleichbar, durch das Wasserstoff leicht von anderen Gasen abtrennbar ist, auch die Aktivierung des Wasserstoffs ist so zu verstehen, die für die Hydrierung von organischen Doppel- und Dreifach-Bindungen von großer Bedeutung ist.
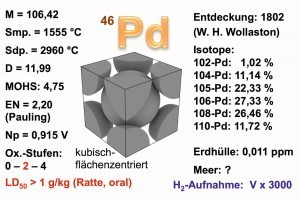 Abb. 3: Eigenschaften des Palladium-Metalls Die Haupt-Oxidationsstufe des Palladiums ist +2, wie beispielsweise im Diammindichlorido-palladium(II), [Pd(NH3)2Cl2]. Für die Oxidationsstufe +4 bedarf es schon starker Oxidationsmittel, wie Chlor. Dennoch zerfällt das Hexachlorido-palladat(IV) bei Temperaturen oberhalb von 60 °C wieder in das zweiwertige Palladium, ein Effekt, der auch im Trennungsgang der Platingruppenmetalle, PGM, seine Anwendung findet:
Abb. 3: Eigenschaften des Palladium-Metalls Die Haupt-Oxidationsstufe des Palladiums ist +2, wie beispielsweise im Diammindichlorido-palladium(II), [Pd(NH3)2Cl2]. Für die Oxidationsstufe +4 bedarf es schon starker Oxidationsmittel, wie Chlor. Dennoch zerfällt das Hexachlorido-palladat(IV) bei Temperaturen oberhalb von 60 °C wieder in das zweiwertige Palladium, ein Effekt, der auch im Trennungsgang der Platingruppenmetalle, PGM, seine Anwendung findet:
H2[PdCl6] – 60 °C → H2[PdCl4] + Cl2.
Die Oberfläche des Palladiums [7] zeigt selbst unter dem Elektronenmikroskop eine gewisse Karlotten-förmige Oberflächen-Rauheit (Abb. 4 A).
Palladium-Pulver sind je nach Einsatz in vielfacher Spezifikation, Habitus und Korngrößen-Verteilung erhältlich [8]. Verschiedene Reduktionsmittel, Parameter und Reaktions-Bedingungen ergeben unterschiedliche Pulver-Ausprägungen: kristallin, plattig, kugelig (Abb. 4 B).
 Abb. 4: REM-Aufnahmen einer Palladium-Oberfläche (A) und Palladium-Pulver für Vielschicht-Kondensatoren (B)
Abb. 4: REM-Aufnahmen einer Palladium-Oberfläche (A) und Palladium-Pulver für Vielschicht-Kondensatoren (B)
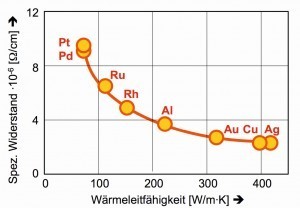
In der Wärmeleitfähigkeit und der Leitfähigkeit bzw. Widerstand des elektrischen Stromes [9] steht das Palladium, gemeinsam mit dem „großen Bruder“ Platin, gegenüber den klassischen Leitungsmetallen Silber, Kupfer und Aluminium deutlich zurück (Abb. 5).
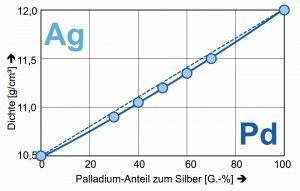
Interessant bei den binären Legierungen von Palladium mit Silber oder Gold sind ihre fast geradlinigen Beziehungen zwischen den Gewichts-Anteilen und der Dichte (Abb. 6). Auf diese Weise lassen sich die binären Legierungen leicht in ihrer Zusammensetzung bestimmen [10].
3 Vorkommen und Gewinnung von Palladium
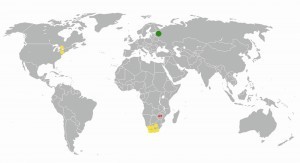 Abb. 7: Globale Palladium-Gewinnung 2005 (Russland: 143 t; grüner Punkt); Gelber Punkt: ca. 15 t, roter Punkt: ca. 1,5 tObwohl die Palladium-Vorkommen im Erdmantel mit 0,011 ppm in sehr niedriger Konzentration erscheinen, ganz zu schweigen von den kaum bestimmbaren Konzentrationen im Meerwasser, befindet es sich vergesellschaftet mit anderen PGM, gediegen legiert, als Oxid oder Sulfid, in einigen Ländern gehäuft. Die Weltkarte mit den nennenswerten Fundorten offenbart die Seltenheit dieses Elements, das offenbar im gesamten asiatischen Raum nicht auffindbar zu sein scheint (Abb. 7).
Abb. 7: Globale Palladium-Gewinnung 2005 (Russland: 143 t; grüner Punkt); Gelber Punkt: ca. 15 t, roter Punkt: ca. 1,5 tObwohl die Palladium-Vorkommen im Erdmantel mit 0,011 ppm in sehr niedriger Konzentration erscheinen, ganz zu schweigen von den kaum bestimmbaren Konzentrationen im Meerwasser, befindet es sich vergesellschaftet mit anderen PGM, gediegen legiert, als Oxid oder Sulfid, in einigen Ländern gehäuft. Die Weltkarte mit den nennenswerten Fundorten offenbart die Seltenheit dieses Elements, das offenbar im gesamten asiatischen Raum nicht auffindbar zu sein scheint (Abb. 7).
Als Spitzenreiter können sich Russland, Süd-Afrika und Kanada bezeichnen (Abb. 8), gefolgt von USA und Simbabwe, die 2017 14 und 12 t Palladium auf den Weltmarkt brachten. Im gesamten PGM-Bereich verfügt Süd-Afrika laut Schätzungen aus dem Jahr 2011 mit 63 000 t über die größten Reserven [11, 12].
In Russland und in Süd-Afrika sind es die Kupfer-Nickel-Chrom-Kiese an beiden Seitenhängen des Ural-Gebirges bzw. die Palladium-Vorkommen im Bushfield-Gebiet. In Kanada enthalten die Kupfer-Nickel-Eisen-Kiese im Sudbury-Becken von Ontario etwas Palladium [13].
Als Palladium-Minerale treten auch einige intermetallische Phasen auf, wie die offizielle „Liste der Minerale“ zitiert:
- Atokit: Pd3Sn; D = 14,19; Mohs-Härte = 4,5
- Cabriit: Pd2SnCu; D = 11,1; Mohs-Härte = 4,0 - 4,5
- Paolovit: PdSn2; D = 11,08; Mohs-Härte = 4,5
- Potarit: PdHg; D = 14,88; Mohs-Härte = 3,5
- Stannopalladinit: (Pd/Cu3) Sn2; Mohs-Härte = 4,5 - 5,0
- Zvyagintsevit: Pd3Pb; D = 13,32; Mohs-Härte = 4,5.
Die Abtrennung der PGM geschieht durch Wasch-, Laugungs- und Elektrolyse-Prozesse der Kupfer-, Nickel- und Chrom-Erze, wobei die Edelmetalle konzentriert als Anoden-Schlamm anfallen. Stark Silber-haltige Erze lassen sich in Schacht- oder Drehrohröfen in Blei oder in anderen Sammlermetallen anreichern. Die oxidierten „Glätten“ (Oxide) lassen sich leicht von der Schmelz-Oberfläche abtrennen und die PGM aus den Anoden-Schlämmen der Blicksilber-Elektrolyse gewinnen.
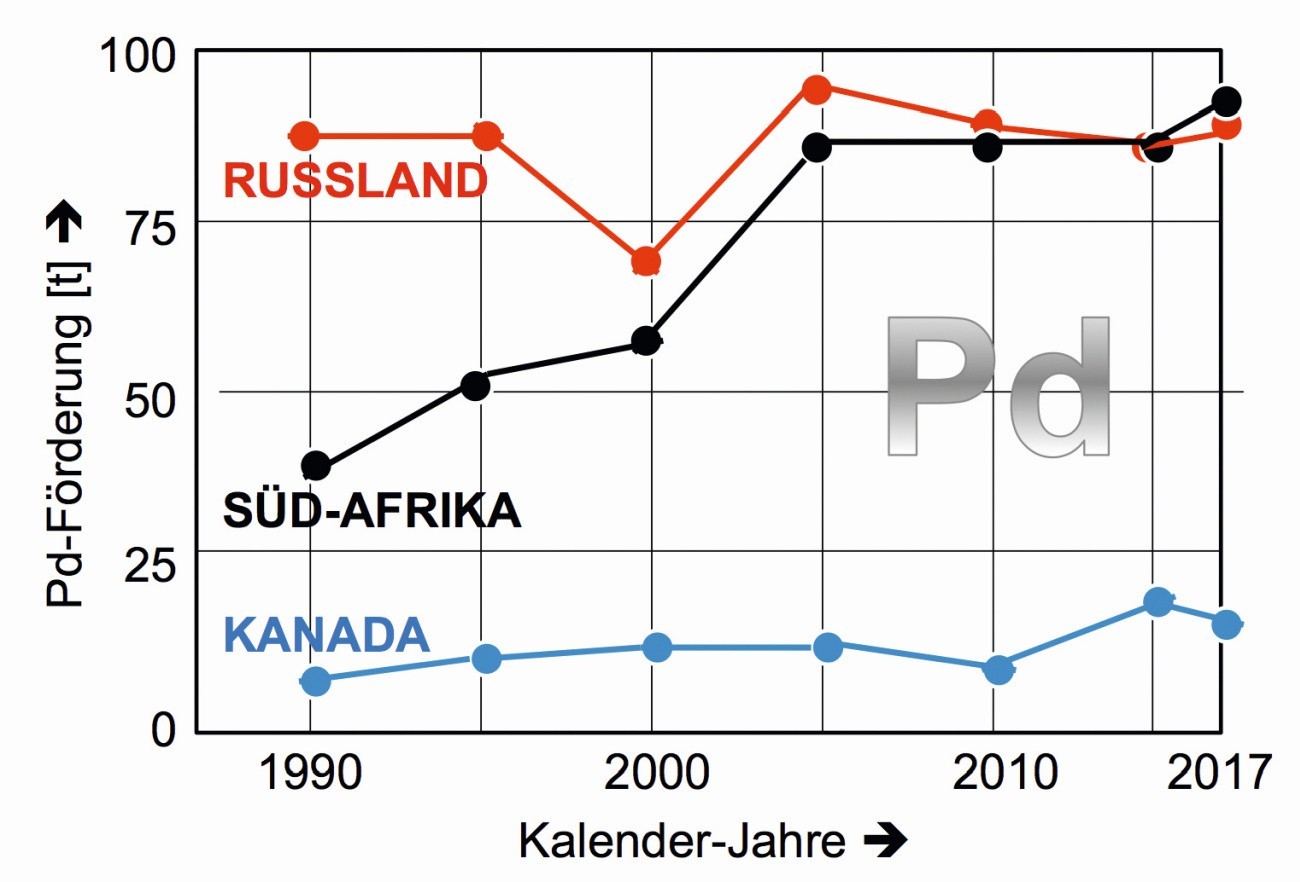 Abb. 8: Regionale Palladium-Förderung 1990 bis 2017 der drei größten Förderländer
Abb. 8: Regionale Palladium-Förderung 1990 bis 2017 der drei größten Förderländer
Für die Abtrennung des Palladiums von den übrigen PGM haben sich, auch aufgrund der Risiken mit der Salmiak-Fällung, die Extraktionen mit den Thioethern Dihexyl- und Dioctylsulfid durchgesetzt [14]. Die Eigenschaften innerhalb der Thioether-Reihe vom Di-n-methyl- bis zum Di-n-octylether zeigt Tabelle 1.
|
Name |
Formel |
M |
Smp. [°C] |
Sdp. [°C] |
Fp [°C] |
D [g/cm3] (20 °C) |
n (20 °C) |
LH2O [g/l] (20 °C) |
H-Sätze |
|
Di-n-methyl-S. |
C2H6S |
62,14 |
-98 |
37 |
-45 |
0,85 |
1,4355 |
2,0 |
225-319 |
|
Di-n-ethyl-S. |
C4H10S |
90,19 |
-104 |
92 |
-10 |
0,84 |
1,442 |
3,2 |
225-315-319 |
|
Di-n-propyl-S. |
C6H14S |
118,2 |
-103 |
143 |
28 |
0,838 |
1,4487 |
0,35 |
225-315-319-412 |
|
Di-n-butyl-S. |
C8H18S |
146,3 |
-80 |
189 |
62 |
0,84 |
1,452 |
315-319-335 |
|
|
Di-n-hexyl-S. |
C12H26S |
202,4 |
260 |
116 |
0,85 |
1,4587 |
315-318-335 |
||
|
Di-n-octyl-S. |
C16H34S |
258,5 |
-1 |
160 |
0,844 |
0,000.005 |
315-319-335 |
Dabei fallen vor allem die Vorteile der Di-n-hexyl- und Di-n-octylthioether bezüglich der geringen Löslichkeit in Wasser und des hohen Flammpunktes als günstige Parameter für eine Extraktion mit hydrophoben Lösungsmitteln, wie z. B. Benzin, auf.
4 Der Palladium-Markt
 Abb. 9: Sowjetische Palladium-Münze Palladium befindet sich als Barren oder als Münzen (Abb. 9) auf dem Anlage-Markt, wo es über Banken zu beziehen ist. Mit einer Reinheit von 999,9 Promille wird es häufig zur Schmuck-Verarbeitung in Legierungen von 950 Promille Palladium oder noch niedriger verwendet. Die Nachfrage des Metalls stieg in den letzten Jahren stetig an. Damit wächst auch die Bedeutung dieses Edelmetalls in der Streuung des Anlagespektrums. Da das reine Palladium für viele Schmuckstücke zu weich ist, enthalten diese einen geringeren Anteil. Als Wertanlage sind daher Barren und Münzen zu empfehlen.
Abb. 9: Sowjetische Palladium-Münze Palladium befindet sich als Barren oder als Münzen (Abb. 9) auf dem Anlage-Markt, wo es über Banken zu beziehen ist. Mit einer Reinheit von 999,9 Promille wird es häufig zur Schmuck-Verarbeitung in Legierungen von 950 Promille Palladium oder noch niedriger verwendet. Die Nachfrage des Metalls stieg in den letzten Jahren stetig an. Damit wächst auch die Bedeutung dieses Edelmetalls in der Streuung des Anlagespektrums. Da das reine Palladium für viele Schmuckstücke zu weich ist, enthalten diese einen geringeren Anteil. Als Wertanlage sind daher Barren und Münzen zu empfehlen.
Die kanadische „Maple Leaf“ mit dem Gewicht einer Unze kostete am 3.8.2020 inklusive Mehrwertsteuer, ohne Versand: 2326,59 Euro. Den 1-Unze-Barren bieten die Edelmetall-Scheidereien Umicore, Heraeus und Degussa für 2407,36 Euro an, den 500g-Barren für 36 416,27 Euro und den 1-kg-Palladium-Barren für 71 012,57 Euro [15].
Während das Palladium als Münze relativ günstig zu erwerben ist, jedoch nur in wenigen Größen, sind die Barren in 10 g, 20 g, 1 Unze (31,1 g), 50 g, 100 g, 500 g und 1000 g erhältlich. Zu Irritationen führt oft die Differenz zwischen Verkaufs- und Ankauf-Kurs von Edelmetallen.Der Ankaufs-Kurs für bankhandelsfähiges 999,5-Palladium in Form von Barren, Tafeln oder Münzen liegt derzeit bei 55,44 Euro/Gramm (alle Preisangaben beziehen sich auf Mitte 2020).
Für Recycling- oder Schmelzpalladium aus Schmuck, Zahngold oder „Scheidgut“ (Abb. 10) liegen die Ankaufs-Kurse gestaffelt bei:
- 41,15 Euro bis 10 g Pd-Inhalt
- 41,72 Euro bis 500 g Pd-Inhalt und
- 44,01 Euro über 500 g Pd-Inhalt.
Das aber heißt, dass der soeben für 71 012,57 Euro gekaufte 1kg-Pd-Barren derzeit für 55 440 Euro zurückgegeben werden kann. Der Anleger muss also auf eine erhebliche Wert-Steigerung hoffen [16].
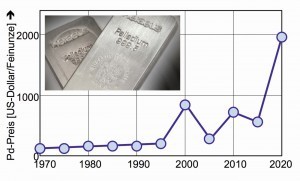
Derzeit jedenfalls erlebt Palladium einen rasanten Preisanstieg (Abb. 11) – selbst Edelmetall-Händler staunen darüber. Eine Preis-Explosion, die Gold in der Weise nie erleben durfte. Noch am Anfang des Jahres 2020 lag die Feinunze bei 1300 Dollar, Mitte des Jahres schoss der Palladium-Preis durch die 2000-Dollar-Decke.
Der Grund liegt nach Experten-Meinung in einer relativ verhaltenen Palladium-Produktion, während die Nachfrage aus der Automobil-Industrie stetig wuchs. Heute liegt der Bedarf in der Automobil-Branche bei 80 %, nachdem die Hersteller ein Großteil des Platins in Autoabgas-Katalysatoren durch das in 2009 relativ preiswerte Palladium ersetzten. Derzeit hat sich ein sehr hohes Angebots-Defizit angestaut [17].
5 Verwendung von Palladium
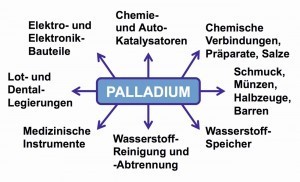 Abb.12: Haupt-Einsatzgebiete für Palladium Die Verwendung des Palladiums ähnelt in vielen Bereichen durch seine vergleichbaren Eigenschaften der des Platins. In der Industrie dient es zur Vergütung von Metallen, in der Wasserstoff-Technologie als Speicher-Medium oder als Katalysator. Beliebt zeigt sich Schmuck aus Palladium, der legiert mit Gold die Goldfarbe verschwinden lässt. Diese Weißgold-Legierungen kommen auch in der Medizin- und Dentaltechnik zum Einsatz.
Abb.12: Haupt-Einsatzgebiete für Palladium Die Verwendung des Palladiums ähnelt in vielen Bereichen durch seine vergleichbaren Eigenschaften der des Platins. In der Industrie dient es zur Vergütung von Metallen, in der Wasserstoff-Technologie als Speicher-Medium oder als Katalysator. Beliebt zeigt sich Schmuck aus Palladium, der legiert mit Gold die Goldfarbe verschwinden lässt. Diese Weißgold-Legierungen kommen auch in der Medizin- und Dentaltechnik zum Einsatz.
Als Wirtschafts-Rohstoff ist der Palladium-Preis stärker an die aktuelle Wirtschaftslage gebunden als Gold, dessen Preis sich noch immer stärker an der Nachfrage von Investoren orientiert.
Für die Geld-Anlage in Form von Barren oder Münzen zeigte sich das graue Edelmetall gerade in den letzten Jahren als sehr attraktiv [18].
Eine Übersicht über die hauptsächlichen Einsatzgebiete des Palladiums veranschaulicht Abbildung 12.
5.1 Wasserstoff-Technologie
Palladium besitzt die höchste Absorptionsfähigkeit aller Elemente für Wasserstoff. Diese grundlegende Entdeckung geht auf Thomas Graham im Jahre 1869 zurück. Bei Raumtemperatur kann es das 900fache, feinverteiltes schwarzes Palladium-Pulver das 1200fache und kolloidale Palladium-Lösungen das 3000fache des eigenen Volumens binden. Die nach Wasserstoff-Sättigung im Metallgitter entstandene „Verbindung“ lässt sich annähernd als Palladiumhydrid mit der ungefähren Zusammensetzung Pd2H auffassen [19].
Da Palladium die Eigenschaft besitzt, Wasserstoff bis zum Mehrtausendfachen in sein Metallgitter einzulagern, wurde es attraktiv für die Speicherung und den Transport dieses Gases. Solar-Kraftwerke der Äquator-Regionen können den nachhaltig produzierten Energieträger Wasserstoff sammeln und über den gesamten Globus hinweg zur Verfügung stellen [20].
Statt mit aus fossilen Energieträgern stammenden Treibstoffen wie Benzin, Diesel oder Erdgas kann ein Auto auch mit Wasserstoff betrieben werden.
Im Vergleich mit den anderen genannten Kraftfahrzeug-Antrieben ist das Wasserstoffauto deutlich umweltfreundlicher. Als noch nachhaltiger stellt sich ein Wasserstoff-Fahrzeug dar, das mit einem Elektromotor ausgestattet ist und seine Energie aus der Umwandlung der chemischen Energie in den Brennstoffzellen bezieht. Die günstigste Antriebs-Variante sehen Fachleute jedoch in Elektroautos, wenn sie mit Strom aus Windkraftwerken betrieben werden [21].
5.2 Einsatz als Katalysator
Palladium dient für viele technische Verfahren als Katalysator. Ein Großteil davon sind teilweise- oder vollständige Hydrierungen. So verläuft z. B. auch die Herstellung von Wasserstoffperoxid nach dem „Anthrachinon-Verfahren“ beim Hydrier-Schritt mit chemisch gefälltem Palladium- Pulver als Katalysator ab [22]:
Anthrachinon + H2/Pd → Anthrahydrochinon … + O2 →
Anthrachinon + H2O2.
Beim „Dreiwege-Katalysator“ in Kfz-Verbrennungsmotoren sorgt das Palladium, zum Teil auch neben dem Platin, für die beiden Wege:
- Oxidation von Kohlenmonoxid zu Kohlendioxid und
- Oxidation von Kohlenwasserstoffen zu Kohlendioxid und Wasser.
Das Rhodium ist hauptsächlich als Katalysator für die Reduktion der Stickoxide zu Stickstoff verantwortlich [23].
Um Alkine nicht ganz durchzuhydrieren (A), sondern nur bis zum Alken (B), kommen „Lindlar-Katalysatoren“ zum Einsatz, ein Verfahren des britisch-schweizerischen Chemikers Herbert Lindlar (1909–2009) bei dem Pharma-Unternehmen Hoffmann-La Roche. Dabei handelt es sich um Calciumcarbonat-Träger mit 5 % aufreduziertem Palladium-Metall, phlegmatisiert („vergiftet“) durch Schwefel o. a. [24]:
A. R-C = C-H + 2 H2 → R-CH2-CH3
(ohne Lindlar-Katalysator
B. R-C = C-H + H2 → R-CH = CH2
(mit Lindlar-Katalysator).
Eine phlegmatisierte Hydrierung läuft ebenfalls unter Verwendung des „Rosenmund-Katalysators“ ab, bei dem Palladium auf Bariumsulfat abgeschieden wurde. Auf diese Weise lassen sich Hydrierprozesse durchführen, bei denen der Wasserstoff ein Acylchlorid zum Aldehyd reduziert. Diese Umsetzung beschrieb Karl Wilhelm Rosenmund (1884–1965) 1918 erstmals [25]. Bariumsulfat dient als Metallträger, limitiert die Aktivität des Palladiums und verhindert so eine Reduktion über die Stufe des Aldehyds heraus.
Als Chlorid kommt das Palladium beim „Wacker-Hoechst-Verfahren“ zum Einsatz, bei dem Ethylen (Ethen) selektiv zum Acetaldehyd oxidiert wird. Als Zwischenstufen treten dabei u. a. die folgenden Verbindungen auf [26]:
- Trichloridoethylenpalladinat(II)-anion:
[Cl3Pd···C2H4]- ,
- trans-Dichlorido-hydroxido-ethylenpalladat(II):
[Cl2(OH)Pd···C2H4]-,
- Trichlorido-2-Hydroxyethyl-Palladium(II):
[Cl3Pd-CH2-CH2-OH]2- .
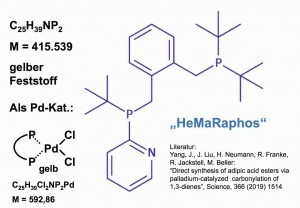 Abb. 13: Molekülstruktur von „HeMaRaphos“, einem Phosphin- Liganden für einen Palladium-Katalysator zur Herstellung von Adipinsäure-DerivatenAuf dem Wege zu einem neuen Verfahren zur Herstellung von Adipinsäure gelangten Forscher aus Hochschule und Industrie durch katalytische Carbonylierung von Butadien mit Hilfe eines speziellen Palladium-Phosphin-Katalysators zu Produkt-Ausbeuten von 95 %:
Abb. 13: Molekülstruktur von „HeMaRaphos“, einem Phosphin- Liganden für einen Palladium-Katalysator zur Herstellung von Adipinsäure-DerivatenAuf dem Wege zu einem neuen Verfahren zur Herstellung von Adipinsäure gelangten Forscher aus Hochschule und Industrie durch katalytische Carbonylierung von Butadien mit Hilfe eines speziellen Palladium-Phosphin-Katalysators zu Produkt-Ausbeuten von 95 %:
H2C=CH-CH=CH2 + 2 CO + 2H2O → HOOC-C4H8-COOH.
Bei dem Palladium-Katalysator handelt es sich um eine neue Verbindung mit speziellem Phosphin-Liganden namens „HeMaRaPhos“ [27] (Abb. 13).
Die Reaktion läuft bei 120 °C und einem Druck von 40 bar innerhalb von 24 Stunden in Butanol ab [28].
Dem neuen Verfahren zur Herstellung von Adipinsäure und seiner Derivate räumen Fachleute eine erfolgreiche Zukunft ein, denn Hersteller von Adipinsäure-Derivaten produzieren jährlich mehrere Millionen Tonnen, die zur Weiterverarbeitung zu Weichmachern, Parfüms, Schmierstoffen, Lösungsmitteln, pharmazeutischen Wirkstoffen und vor allem Nylon dienen.
5.3 Halbzeuge für die Schmuck-Industrie
Wie auch für die anderen gängigen Edelmetalle vertreiben Scheidereien und Edelmetall-Händler auch Palladium-Halbzeuge z. B. für die Schmuckhersteller. Wie bei anderen Edelmetallen handelt es sich auch beim Palladium um Drähte, Bleche, Bänder, Stangen, Rohre in unterschiedlichen Durchmessern und Profilen, Lot- und Guss-Legierungen. Zum Großteil liegen diese Halbzeuge aber nicht als Lagerware vor, sondern müssen zeitnah nach Kunden-Wünschen angefertigt werden. Folglich sind die spezifizierten Anfertigungen und Zuschnitte vom direkten Umtausch ausgeschlossen.
Schmuck-Hersteller schätzen vor allem Palladium und Weißgold für Ringe, Ohrschmuck und Ketten mit Diamant-Besatz. Wie Platin ist auch Palladium sehr korrosionsbeständig und ihre Härte deutlich höher als die des Goldes. Palladium behält seinen Glanz und seine dunkelgraue Farbe permanent und erleidet kein Anlaufen.
Palladium verhält sich beständiger gegen Abrieb als Weißgold. Somit sitzen eingeschlossene Diamanten oder Perlen fest umschlossen in den Schmuckstück-Fassungen. Auch die vergleichsweise geringe Dichte (D = 12,0) gegenüber Gold (D = 19,3) und Platin (D = 21,5) macht das Palladium attraktiv [29].
5.4 Dental-Legierungen
Für die Zahntechnik bieten die Edelmetall-Händler spezielle Palladium-Legierungen in Form kleiner Legierungs-Chips in Gewichtseinheiten von einem oder weniger Gramm an. So lassen sich Kronen, großspannige Brücken, Fräs-, Konus- und Geschiebearbeiten sowie Modellguss-Arbeiten herstellen, die mit geeigneter mittel- und hochschmelzender Keramik verblendbar sind.
So erreicht beispielsweise eine Dental-Legierung aus 75 % Palladium, 8,5 % Silber, 6,0 % Gold, 3,6 % Zinn sowie Spuren von Gallium und Ruthenium eine Vickers-Härte von 250 und eine Dichte von nur 11,6 g/cm³ mit einer weißen Metallfarbe [30].
In Deutschland sind über 1400 Dental-Legierungen zugelassen [31]. Diese Legierungen, wie auch Dental-Lote und Dental-Drähte für Spangen unterliegen entsprechenden Normen. Für Palladium-Legierungen gelten
- DIN EN ISO 8891 für Legierungen mit einem Edelmetall-Anteil zwischen 25 % und 75 %
- DIN EN ISO 969327 für Legierungen zur Herstellung Metallkeramik (VMK) (Aufbrennlegierung)
- DIN EN ISO 15841 Zahnheilkunde – Drähte für die Kieferorthopädie
- DIN EN 29333 Zahnheilkunde – Hartlote und DIN EN ISO 9333 Zahnheilkunde – Dentallote.
5.5 Medizinische Geräte und -Instrumente
In dem hochtechnologisch und sensiblen Bereich der Medizintechnik können nur Materialien zum Einsatz kommen, die vielfältigen Ansprüchen und Belastungen gewachsen sind. Das ist in vielen Fällen nur den Edelmetallen abzuverlangen. Dabei ist auch das Palladium, neben Silber, Gold und Platin, ein unverzichtbarer Rohstoff.
Palladium-Legierungen sind in Herzschrittmachern und Defibrillatoren zu finden. Feinste Platinmetall-Drähte, dünner als das menschliche Haar, kommen bei lebensbedrohlichen Aneurysmen zum Einsatz, indem sie Gefäße stabilisieren und Hirnblutungen verhindern [32].
Die Aerosol-Medikamenten-Applikation mit vibrierenden Palladium-Netzen ist ein Beispiel für innovative, mit Auszeichnungen bedachte Medizin-Präzisionstechnik, die bereits bei mehreren Millionen Patienten ihre erfolgreiche Anwendung fand [33].
Viele medizintechnische Legierungen haben die individuellen Körper-Verträglichkeiten von Patienten zu berücksichtigen. Mit Titan-Palladium-Legierungen z. B. lässt sich diese Bedingung erfüllen [34].
Der weitere Einsatz von Palladium ist bei anspruchsvollen medizinischen Instrumenten sowie bei Oberschicht-Vergütungen von Implantaten zu finden.
5.6 Elektro- und Elektronik-Industrie
Eine nennenswerte Anzahl von Elektro- und Elektronik-Bausteinen enthalten Palladium, seine Legierungen oder Doublés.
So steckt Palladium beispielsweise in Kontaktwerkstoffen für Relais in Kommunikationsanlagen, in Pd/Ni- Legierungen als Ersatz für Gold in der Elektroindustrie, in Elektroden-Werkstoffen für Brennstoffzellen, Zündkerzen, in Halbleiter-Bauelementen auf Basis von Galliumnitrid oder in Leiterplatten-Beschichtungen.
Im Inneren eines jeden Smartphones befinden sich unterschiedliche edelmetallhaltige Bestandteile, wie Gold, Silber und Palladium. Sie sind sowohl in den Komponenten als auch für die Verbindungen zwischen den einzelnen Bauteilen im Einsatz [35]. Auch in jedem PC sind Palladium-haltige Komponenten enthalten, was bei der geringen Reichweite dieses Edelmetalls ein weitgehend quantitatives Recycling erforderlich macht [36].
– wird fortgesetzt –
Literatur
[1] Weeks, M.E.: Discovery of the Elements, Journal of Chemical Education, 6. Aufl. (1956) 409
[2] https://de.wikipedia.org/wiki/(2)_Pallas
[3] Wollaston, W.H.: On a New Metal, Found in Crude Platina, Phil. Trans. R. Soc. 94 (1804) 419–430
[4] Graham, Th.: On the relation of hydrogen to palladium, Proceedings of the Royal Society of London. 17 (1869) 212–220
[5] Phillips, F.C., Am. Chem. J., 16 (1894) 255–277
[6] Edelmetall-Taschenbuch, Degussa (1967) 72
[7] http://forkat.anorg.chemie.tu-muenchen.de/biblio/texte/pdf
[8] Edelmetall-Taschenbuch, Degussa, Hüthig (1995)
[9] https://www.wotech-technical-media.de/womag/ausgabe/2013/10/21_w_edelmetalle_schade_10j2013/21.php
[10] Edelmetall-Taschenbuch, Degussa (1967) 70
[11] https://de.wikipedia.org/wiki/Platinmetalle/Tabellen_und_Grafiken
[12] https://de.wikipedia.org/wiki/Palladium
[13] Holleman; Wiberg: Anorganische Chemie, Bd. 2, 103. Aufl. (2017) 2039
[14] https://de.wikipedia.org/wiki/Thioether
[15] https://www.kettner-edelmetalle.de/Palladium
[16] https://www.scheideanstalt.de/aktuelle-ankaufskurse/palladium/
[17] https://www.handelsblatt.com/finanzen/maerkte/devisen-rohstoffe/rohstoffe-warum-der-palladium-preis-seit-jahresbeginn-explodiert/
[18] https://feingoldhandel.de/palladium-das-silberweisse-edelmetall
[19] Aston, J.G.; Mitacek, P. Jr.: Structure of hydrides of palladium, Nature, London, UK., 195 (1962) 70–71
[20] https://www.pv-magazine.de/2017/09/01/solarstrom-wirtschaftlich-in-wasserstoff-umwandeln/
[21] https://www.seilnacht.com/Lexikon/swasser.html
[22] https://de.wikipedia.org/wiki/Anthrachinon-Verfahren
[23] Kickelbick, G.: Chemie für Ingenieure, Pearson Deutschland, (2008) 155
[24] https://de.wikipedia.org/wiki/Herbert_Lindlar
[25] Rosenmund, K.W.: Über eine neue Methode zur Darstellung von Aldehyden, 1. Mitteilung, Berichte der deutschen chemischen Gesellschaft. 51 (1918) 585–593
[26] Steinborn, D.: Grundlagen der metallorganischen Komplexkatalyse, Teubner, Wiesbaden (2007) 283–292
[27] https://www.chemhui.com/pro/37668
[28] Yang, J.; Liu, J.; Neumann, H.; Franke, R.; Jackstell, R.; Beller, M.: Direct synthesis of adipic acid esters via palladium-catalyzed carbonylation of 1,3-dienes, Science, 366 (2019) 1514
[29] https://goetze-gold.de/halbzeuge-zuschnitt/blech/platin-und-palladium/
[30] https://www.wegold.de/produkte/legierungen/palladium-basis-legierungen/676-wegold-dg-dentallegierung
[31] https://de.wikipedia.org/wiki/Dentallegierungen
[32] https://www.edelmetalle.org/medizintechnik/
[33] https://www.aerogen.com/de/technologie/
[34] https://patents.google.com/patent/DE60003490T2/de
[35] https://www.edelmetalle.org/elektronik/
[36] Buth, M.A.: Palladium aus PC und Elektronik, Sonderband, adrenalinemedia (2012)
[37] RÖMPP, Lexikon Chemie, 8.Aufl., Bd. 4 (1985) 2973
[38] https://de.wikipedia.org/wiki/Ilja_Iljitsch_Tschernjajew
[39] https://de.wikipedia.org/wiki/Trans-Effekt
[40] Tanaka, M.: Structure of Bis(tri-tert-butylphosphin)palladium(0), Acta Cryst., C48 (1992) 739–740
[41] He, L.-Y.: Bis(tri-tert-butylphosphine)palladium(0) [Pd(t-Bu3P)2], Synlett, 26/6 (2015) 551–852
[42] https://shop.jentner.de/galvanische-elektrolyte/edelmetall-elektrolyte/Palladiumbad/
[43] Talgner, F.; Myers, M.; Schmidt, H.: Galvanisch Silber- Palladium als Kontaktoberfläche, Galvanotechnik, Leuze Verlag, 05 (2017) 910
[44] Hasenpusch, W.: Explosivität von Tetramminmetallnitraten, J. prakt. Chem, Chemiker-Zeitung 335 (1993) 193–196
[45] Chemiker-Fachausschuss d. Gesellschaft „ Metall und Erz“: Analyse der Metalle I: Schiedsverfahren, Springer-Verlag, Berlin (1942) 184
[46] Burger,K.; Dyrssen, D.; Johansson, L.; Norén, B.; Munch-Petersen, J.: On the Complex Formation of Palladium with Dimethylglyoxime, Acta Chemica Scandinavica, 17 (1963) 1489
[47] Fries, J.; Getrost, H., Merck, E., Darmstadt: Organische Reagenzien für die Spurenanalyse (1975) 285
[48] https://en.wikipedia.org/wiki/Palladium(II)_bis(acetylacetonate)
[49] Setsune, J.: Palladium chemistry in recent porphyrin research Journal of Porphyrins and Phthalocyanines, 08/01(2004) 93–102
[50] To, W.; Liu, Y.; Lau, T.; Che, C.: A Robust Palladium(II)-Porphyrin Complex as Catalyst for Visible Light Induced Oxidative C-H Functionalization, Chemistry – A European Journal, 19/18 (2013)
[51] https://www.umweltbundesamt.de/platin-palladium#hinweise-zum-Recycling
[52] https://www.bmu.de/fileadmin/Daten_BMU/Pools/Forschungsdatenbank/fkz_3711_93_339_substitutionspotenziale_Metalle_bf.pdf
[53] Edelmetalltaschenbuch, Degussa AG, Frankfurt, Hüthig- Verl. Heidelberg (1995) 48
[54] Doduco-Datenbuch, Pforzheim (1974) 351
[55] Bertau, M.; Müller, A.; Fröhlich, P.; Katzberg, M.: Industrielle Anorganische Chemie, 4. Aufl., Wiley-Verlag, Weinheim (2013) 363–371
[56] Metall Forschung und Entwicklung, Degussa AG (1991) 33-44
[57] Annual Seminar Proceedings of the International Precious Metals Institute, IPMI, USA
[58] Knothe, M.; Hasenpusch, W.: The formation of explosive chlorine-nitrogen compounds during the processes of precious metals separation, Journal of Hazardous Materials, 56 (1997) 137–148
[59] https://de.wikipedia.org/wiki/Ameisensaeure
[60] https://capital.com/de/palladium-preisentwicklung
[61] https://www.boerseonline.de/nachrichten/rohstoffe/voruebergehende-flaute-warum-der-palladium-preis-bald-wieder-steigen-duerfte-102934254