5.7 Preparados de paladio
El paladio suele tener un número de oxidación de +2 en sus compuestos. En los complejos y quelatos, el paladio doblemente cargado positivamente se presenta como átomo central de compuestos planares cuadrados, como también se conoce del cobre, el níquel y el platino. Los compuestos de Pd(II) pueden oxidarse fácilmente al estado de oxidación tetravalente, que, sin embargo, revierte a paladio divalente a temperaturas elevadas:
[PdCl4]2- + Cl2 ↔ [PdCl6]2-
El hexacloridopaladato(IV), que es relativamente poco soluble como sal de potasio o amonio, se descompone a 60 °C de nuevo en tetracloridopaladato(II) fácilmente soluble.
Además de los estados de oxidación más comunes +2 y +4, el paladio también se encuentra con menos frecuencia en los estados de oxidación 0 y +5. En la Tabla 2 se resumen los compuestos de paladio más populares y sus propiedades conocidas.
|
Nombre |
Fórmula |
Color |
M |
Smp. [°C] |
D (20 °C) |
LH2O (20 °C) [g/l] |
Palabra de señal |
Frases H |
|
Óxido de Pd(II) |
PdO |
negro |
122,42 |
750 (Z.) |
8,3 |
poco soluble |
Peligro |
272 |
|
Óxido de Pd(IV) |
PdO2 |
negro |
138,42 |
200 (Z.) |
poco soluble |
Atención |
272-413 |
|
|
Sulfuro de Pd(II) |
PdS |
marrón |
138,49 |
950 (Z.) |
6,7 |
poco soluble |
Atención |
315-319-335 |
|
Fluoruro de Pd(II) |
PdF2 |
violeta claro |
144.42 |
952 |
5,76 |
Hidrólisis |
||
|
Cloruro de Pd(II) |
PdCl2 |
marrón rojizo |
177,3 |
590 (subl.) |
4,0 |
poco soluble |
Peligro |
290-302-317-318-410 |
|
Bromuro de Pd(II) |
PdBr2 |
negro |
266,2 |
310 (Z.) |
5,35 |
poco soluble |
Atención |
315-319-335 |
|
Yoduro de Pd(II) |
PdI2 |
negro |
360,2 |
350 (Z.) |
6,0 |
ligeramente soluble |
Atención |
317 |
|
Pd(II)-cianuro |
Pd(CN)2 |
amarillo |
158,5 |
26 |
2,2 |
poco soluble |
Peligro |
330-310-300-400-410 |
|
Cloruro de Pd(II) tetramina |
[Pd(NH3)4]Cl2 |
amarillo claro |
245,4 |
bien soluble |
||||
|
Hidrogenocarbonato de Pd(II) tetramina |
[Pd(NH3)4] (HCO3)2 |
amarillo claro |
264,4 |
169-174 |
2,04 |
soluble |
Peligro |
317-318-372-410 |
|
Diamminedicloruro- Pd(II) |
[Pd(NH3)2Cl2] |
amarillo |
211,4 |
2,75 |
||||
|
Diammindinitro- Pd(II) |
[Pd(NH3)2(NO2)2] |
amarillo claro |
232,5 |
poco soluble |
||||
|
Nitrato de Pd(II) |
Pd(NO3)2 - 2 H2O |
marrón rojizo |
266,7 |
Hidrólisis |
Peligro |
272-315-319-335 |
||
|
Sulfato de Pd(II) |
PdSO4 |
marrón rojizo |
202,5 |
Hidrólisis |
Peligro |
314 |
||
|
Acetato de Pd(II) |
Pd(CH3COO)2 |
marrón dorado |
224,5 |
205 (Z.) |
2,19 |
poco soluble |
Peligro |
317-318-319 |
|
Hexacloridopaladato (IV) de amonio |
(NH4)2[PdCl6] |
rojo oscuro |
355.2 |
Atención |
302-315-319 |
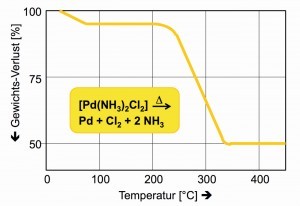
La densidad del cianuro de paladio(II) se interpoló a partir de las densidades de los compuestos análogos (Fig. 14).
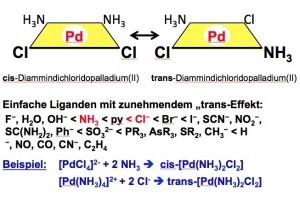 Fig. 15: Síntesis selectiva de isómeros mediante el "efecto trans" Dado que los polvos de paladio suelen producirse también a partir del cloruro en las plantas de preparación, los fabricantes tienen numerosos requisitos y especificaciones especiales. Esto se debe a que los polvos depositados eléctricamente tienen un hábito diferente al de los polvos precipitados químicamente con formaldehído, hidracina, boranato o muchos otros agentes reductores bajo diversas condiciones de parámetros. Muchas sales de paladio se basan en los conocimientos adquiridos en experimentos con compuestos de platino.
Fig. 15: Síntesis selectiva de isómeros mediante el "efecto trans" Dado que los polvos de paladio suelen producirse también a partir del cloruro en las plantas de preparación, los fabricantes tienen numerosos requisitos y especificaciones especiales. Esto se debe a que los polvos depositados eléctricamente tienen un hábito diferente al de los polvos precipitados químicamente con formaldehído, hidracina, boranato o muchos otros agentes reductores bajo diversas condiciones de parámetros. Muchas sales de paladio se basan en los conocimientos adquiridos en experimentos con compuestos de platino.
Por ejemplo, el químico danés Sophus Mads Jørgensen (1837-1914), hijo de un maestro sastre, pudo demostrar que la "sal de Vauquelin", que fue el primer complejo de paladio presentado por el farmacéutico y químico francés Louis Nicolas Vauquelin (1763-1829), debe entenderse como un compuesto análogo a la sal de platino verde del físico y químico berlinés Heinrich Gustav Magnus (1802-1870), la "sal de Magnus" [37]. La "sal de Vauquelin" de color rojo carne [Pd(NH3)4] [PdCl4] es análoga a la "sal de Magnus" de color verde [Pt(NH3)4] [PtCl4]. Como compuestos catión-anión en proporción 1:1, estos complejos dobles también son relativamente poco solubles en agua. Los complejos neutros suelen ser igualmente poco solubles en agua.
Según los trabajos del químico francés J. Reiset (1818-1896), que describió los compuestos cloruro de tetraminpalladium(II), (sal de Reiset I), [Pt(NH3)4]Cl2 y trans-diamminedichloridoplatin(II), (sal de Reiset II), [Pt(NH3)2Cl2] y la isomérica cis-diamminedichloroplatin(II), (sal de Peyrone) del químico italiano Michele Peyrone (1813-1883), también se han preparado los complejos de paladio(II) correspondientes.
Para la producción estereoselectiva de complejos isoméricos planares cis y trans, el químico ruso Ilya Ilyich Chernyaev (1893-1966) descubrió el "efecto trans" en 1926 [38, 39].
Si, por ejemplo, se utiliza tetracloridopaladato(II) como punto de partida, el complejo monoamínico se obtiene por reacción con amoníaco en el primer paso. Debido a las propiedades de transdirección más fuertes del ligando clorido en comparación con el ligando amino, se incorpora una segunda molécula de amoníaco en la posición trans al ligando clorido y, por tanto, en la posición cis al primer ligando amino (Fig. 15).
El estado de oxidación cero del paladio se encuentra, por ejemplo, en el bis(tri-terc-butilfosfina)paladio(0) (Fig. 16 ), que se utiliza como catalizador y cuya estructura fue determinada por científicos japoneses en 1992 [40].
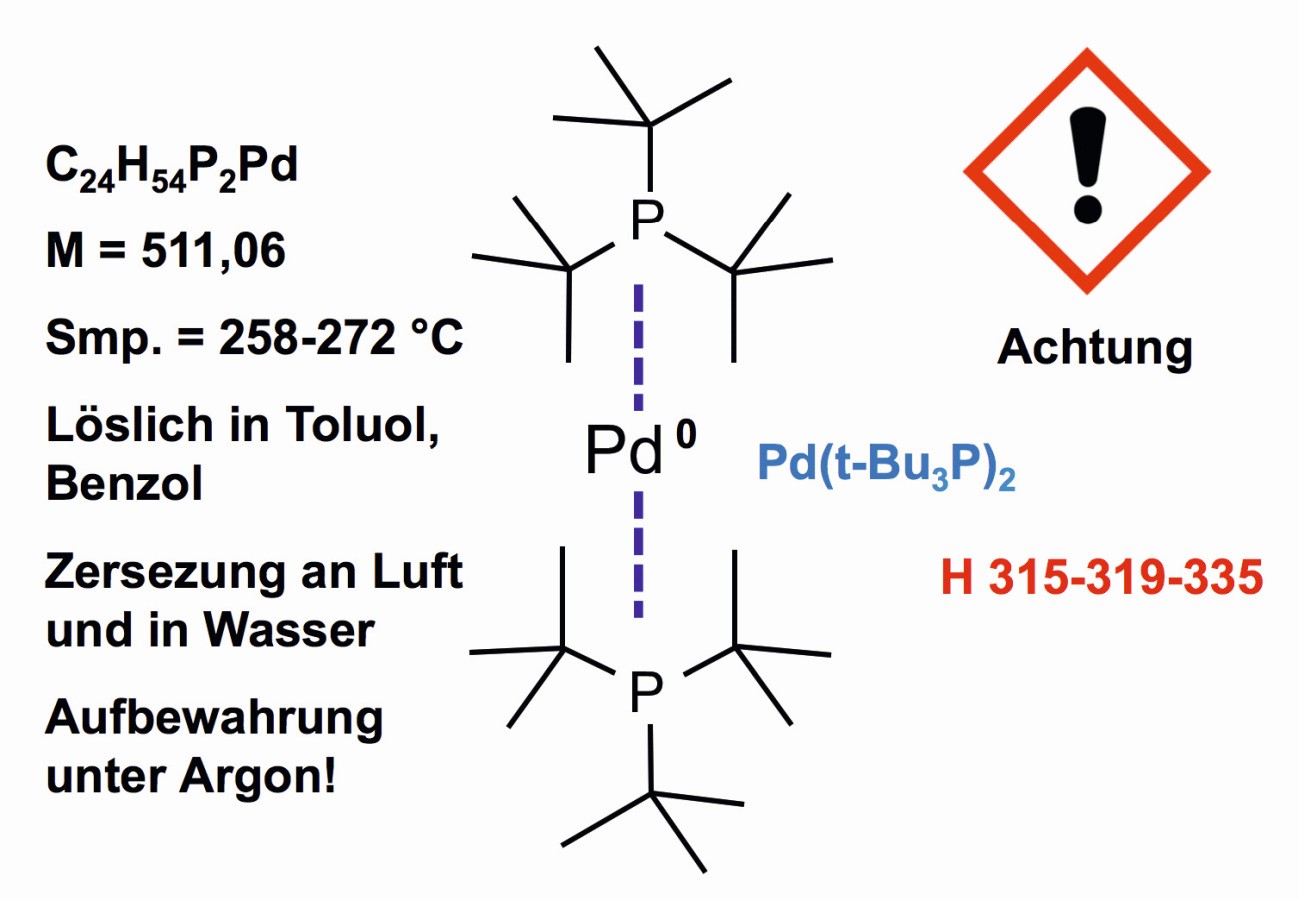 Fig. 16: Paladio en estado de valencia cero en bis(tri-terc-butilfosfina)paladio(0)
Fig. 16: Paladio en estado de valencia cero en bis(tri-terc-butilfosfina)paladio(0)
El compuesto está disponible en el mercado de preparación de metales preciosos. Se produce bajo gas inerte. El compuesto desempeña un papel entre la nueva generación de catalizadores para síntesis orgánicas [41].
5.8 Baños galvánicos
 Fig. 17: Compuestos explosivos depaladioLa muy buena resistencia a la corrosión y a la temperatura también hace que el paladio sea interesante para su uso como recubrimiento protector de materiales base.
Fig. 17: Compuestos explosivos depaladioLa muy buena resistencia a la corrosión y a la temperatura también hace que el paladio sea interesante para su uso como recubrimiento protector de materiales base.
Los electrolitos débilmente alcalinos de la serie de los metales ligeros del platino con paladio producen un color similar al del rutenio o el rodio. Con estos baños pueden conseguirse capas superficiales muy brillantes, blancas y altamente decorativas de hasta 0,5 µm.
Los baños de paladio son muy adecuados para crear capas de barrera. Se utilizan si la capa final va a ser de rodio, por ejemplo, ya que estos dos metales preciosos tienen un color muy similar [42].
La industria de la joyería y las gafas utiliza baños de paladio con 2 g de paladio/litro para capas de paladio de alto brillo, decorativas y brillantes de hasta 0,5 µm de grosor.
Las aleaciones de metales preciosos también pueden galvanizarse. Por ejemplo, una aleación de plata y paladio 10 es muy adecuada para contactos de conectores que se utilizan en aplicaciones de alta polaridad o alta temperatura. El proceso de galvanoplastia permite un control estable del proceso con propiedades de capa consistentes. La dureza de la capa, la resistencia de contacto y las propiedades tribológicas de la aleación son estables durante largos periodos de hasta 200 °C. La resistencia a la vibración de la capa de contacto también se da con contacto a la plata estándar [43].
A menudo se está intentando utilizar electrolitos sin halógenos para los baños galvánicos. Para ello se utilizan una serie de nitratos y compuestos de paladio con ligandos de amina y nitrito (Fig. 17). Al manipular y procesar estos compuestos debe tenerse en cuenta que pueden reaccionar de forma explosiva [44].
6 Análisis del paladio
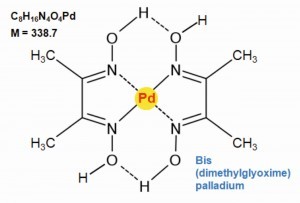
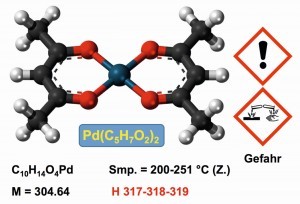
En los laboratorios analíticos de las empresas de metales preciosos dominan los métodos de determinación física del análisis por fluorescencia de rayos X y el método de determinación multielemento ICP (Induce Coupled Plasma). No obstante, la precipitación clásica con dimetilglioxima también se utiliza como análisis de referencia para el paladio [45].
La dimetilglioxima se utiliza para precipitar paladio(II) cuantitativamente a partir de soluciones de ácidos minerales diluidos a pH = 2 como bis(dimetilglioximato)-paladio(II) (Fig. 18). En un medio básico, a un valor de pH superior a 9, el precipitado vuelve a disolverse.
Los complejos dimetilglioxima-níquel y platino tienen la misma composición que el compuesto de paladio, pero se disuelven en ácidos y permiten así la separación cuantitativa del paladio del níquel y el platino [46, 47].
Otros compuestos de paladio poco solubles son los complejos neutros con acetilacetonato (Fig. 19). Este compuesto también sirve como catalizador [48]. Los ligandos acetilacetonato fluorados pueden utilizarse incluso para recubrir metales en el vacío por descomposición térmica.
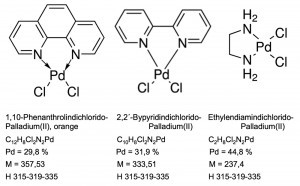
Incluso el diamminedichloridopalladium(II), [Pd(NH3)2Cl2], es relativamente insoluble en agua a temperatura ambiente. Si los ligandos amoniacales se sustituyen por compuestos orgánicos de diamina, como el etilendiaminodicloro-paladio o el 2,2'-bipiridindicloro-paladio, así como el 1,10-fenantrolindicloro-paladio, también pueden utilizarse analíticamente en el contexto de operaciones de precipitación cuantitativa (Fig. 20).
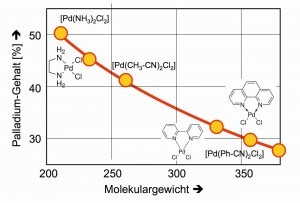
Si se comparan en un diagrama los contenidos de paladio con los pesos moleculares de los complejos poco solubles, se puede ver cómo el tamaño de los ligandos puede mejorar los resultados de los análisis de paladio, ya que los errores de pesada tienen un efecto correspondientemente menor (Fig. 21).
Una química muy interesante se centra en los derivados de porfirina-paladio [49], que permiten determinaciones cuantitativas debido a su falta de solubilidad en agua, alcohol, éter y alcanos, ya que el contenido de paladio en estos compuestos es especialmente bajo (Fig. 22). La solubilidad de estos complejos neutros en acetonitrilo, diclorometano o dimetilformamida (DMF), así como en pequeñas cantidades en acetona, también permite realizar determinaciones fotométricas cuantitativas de estos complejos rojos, que también sirven como robustos fotocatalizadores [50].
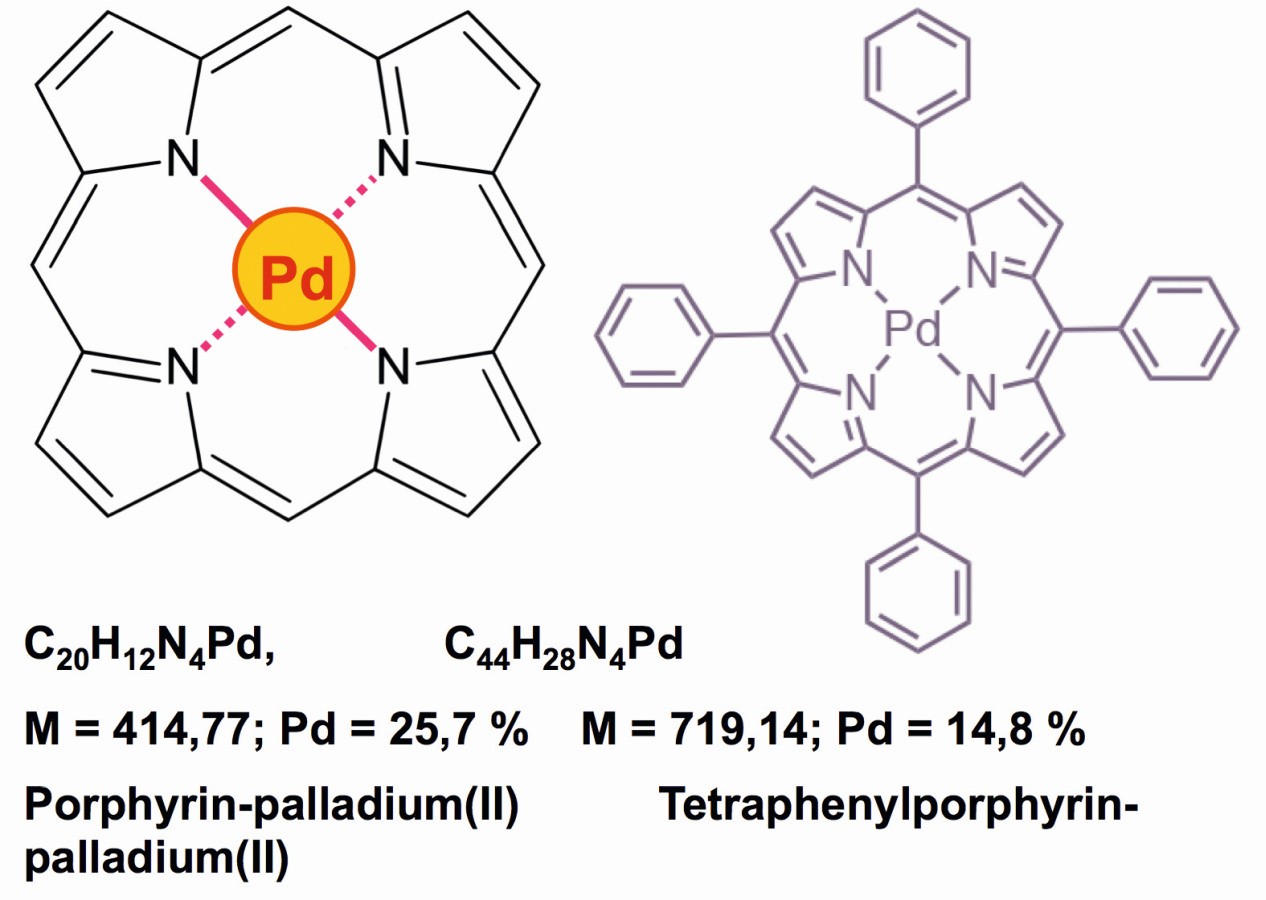 Fig. 22: Compuestos rojos de porfirina de paladio
Fig. 22: Compuestos rojos de porfirina de paladio
7 Reciclaje del paladio
Los prerrequisitos para un reciclaje extensivo son
- Diseños que faciliten el reciclaje
- Información sobre la conservación de los recursos de chatarra y escoria que contienen paladio
- Logística de recogida optimizada
- Buena infraestructura de plantas de reprocesado
- Optimización de los procesos de acuerdo con la mejor tecnología disponible
- La conservación de los recursos como prioridad
Para todos los recursos de elementos raros, el componente económico es desgraciadamente la máxima prioridad. Esto provoca pérdidas considerables: por conveniencia, por ignorancia, por insuficiencias técnicas y logísticas y por accidentes.
La figura 23 muestra un balance de los flujos de materiales para el reprocesamiento de residuos de paladio procedentes de la producción y los consumidores en 2015. La mayor proporción de devoluciones de paladio corresponde, con diferencia, a los catalizadores, los componentes electrónicos y los vehículos al final de su vida útil [51].
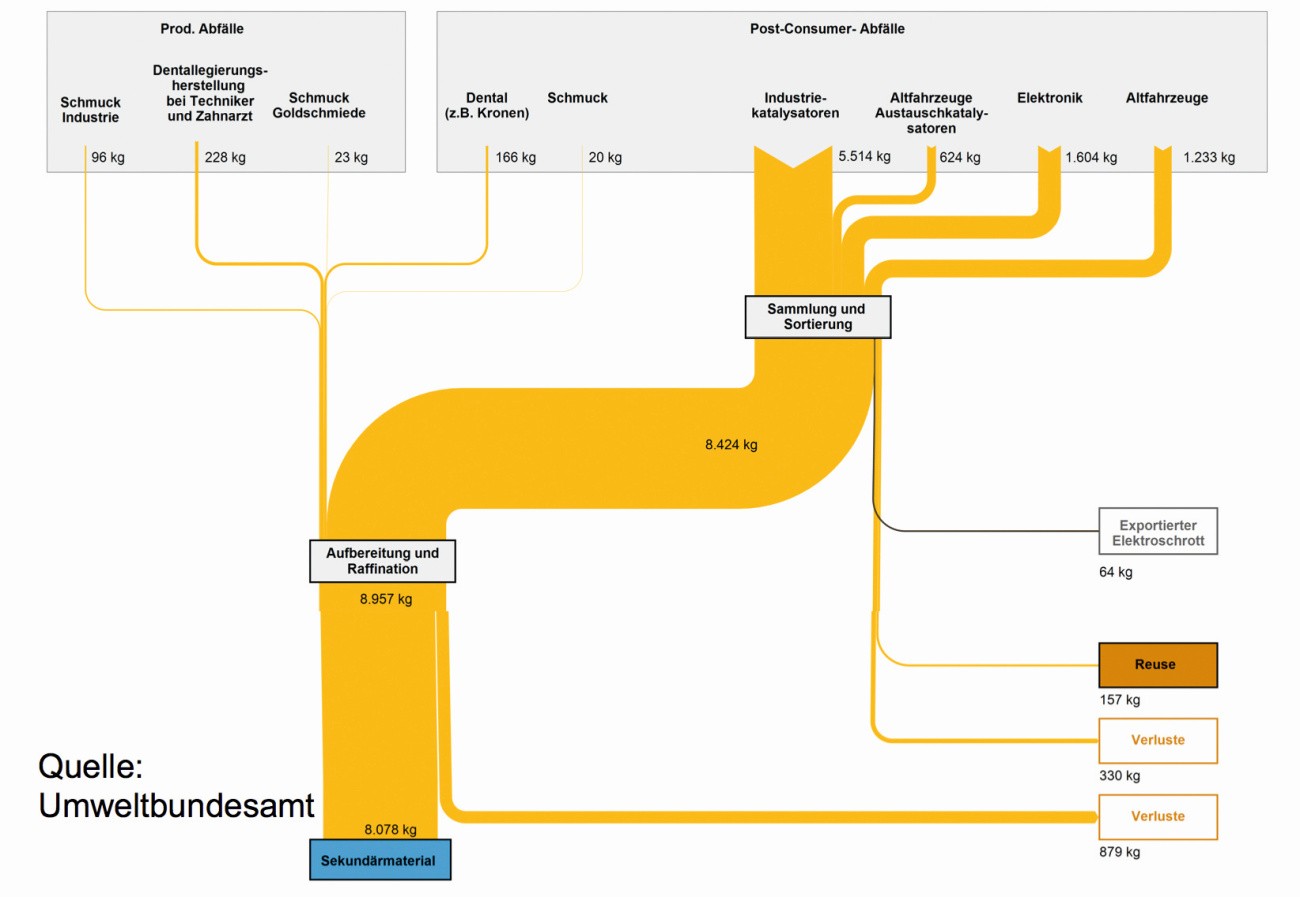 Fig. 23: Flujos de materiales del reciclaje de paladio en Alemania en 2015
Fig. 23: Flujos de materiales del reciclaje de paladio en Alemania en 2015
Sólo en las rutas largas de uso del paladio, desaparece entre el 10 y el 30 % del metal: algunos de los catalizadores químicos de los distintos soportes, como el carbón activado, el carbonato cálcico, etc., se pierden en el producto, mientras que muchos de los componentes electrónicos acaban en residuos o vertederos, donde el paladio se pierde para siempre. En el caso de los catalizadores de los tubos de escape de los coches, el grado en que la "capa de lavado" que contiene los metales preciosos es barrida del tubo de escape depende del estilo de conducción del propietario del vehículo. En el caso de coches rebajados, con algunos golpes de los bajos contra bordillos y carreteras irregulares, así como a velocidades superiores a 200 km/h, seguramente no queda mucha cerámica de catalizador en el sistema de escape.
En 2016, el Ministerio Federal de Medio Ambiente, BMU, encargó una investigación sobre los recursos para 2020. Sobre la base de los productos analizados, los valores de referencia y medios dan como resultado una cantidad total esperada de paladio de 14.201 kg en 2020. El rango de la cantidad determinada se extiende de 13.737 a 14.664 kg. Las mayores contribuciones proceden de los catalizadores industriales usados, con 10.307 kg, seguidos de los catalizadores de automoción, con 3.578 kg. Los centros informáticos contribuyen sólo ligeramente al reciclado de paladio con unos 316 kg [52].
Los separadores de metales preciosos disponen de procesos de separación para procesar los residuos de paladio que están más o menos adaptados al material de entrada. En algunos casos, la cloración a alta temperatura de las aleaciones a 800 °C es suficiente para eliminar los restos de metal base. La precipitación con hidracina de los metales preciosos o los procesos de intercambio iónico, por ejemplo, se utilizan para metales preciosos fuertemente acompañados de metales base.
Si, además del paladio, están presentes otros metales preciosos, se utilizan procesos de separación específicos o generales [53-57].
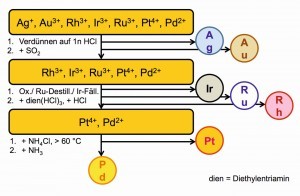
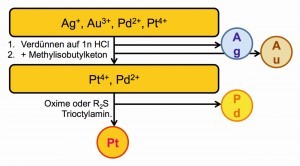
Puede tratarse de un proceso de separación de metales preciosos con precipitación predominantemente selectiva (Fig. 24) o de separaciones mediante extracciones líquido-líquido entre los medios agua y gasolina u otros disolventes orgánicos no miscibles con agua (Fig. 25).
El paladio se suele separar utilizando el hexaclorido-paladato(IV) de amonio, poco soluble, (NH4)2[PdCl6]/Cl2, mediante oxidación con gas cloro. Curiosamente, estas precipitaciones siempre se producían sin incidentes.
En el instituto de investigación de Freiberg, experimentos análogos mostraron que el tricloruro de nitrógeno, NCl3, un compuesto extremadamente explosivo, se forma como reacción secundaria de esta precipitación [58]. El tricloruro de nitrógeno, que es aceitoso a temperatura ambiente, se acumula en el fondo del reactor con una densidad de 1,64, pero con un punto de ebullición de 71 °C es casi tan volátil como el alcohol.
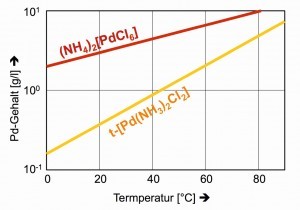
Las escasas solubilidades de los precipitados clásicos en el canal de separación, el rojo oscuro (NH4)2[PdCl6] y el amarillo trans-[Pd(NH3)2Cl2], sólo son satisfactorias a temperaturas más bajas (Fig. 26).
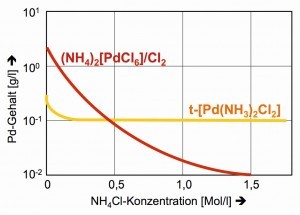
La solubilidad del hexacloropaladato(IV) puede reducirse aún más mediante cloruro amónico, un método común de salado, que naturalmente falla con el complejo neutro [Pd(NH3)2Cl2] (Fig. 27).
La descomposición térmica del dicloruro diamino de paladio(II) en el rango de temperaturas de 600 a 800 °C garantiza un método fiable para obtener paladio groseramente cristalino, también conocido como "esponja de paladio" (Fig. 28).
Especialmente en institutos de investigación y pequeñas empresas, los técnicos se ven tentados a realizar precipitaciones con ácido fórmico, formiato, hidracina o boranato sin precauciones de seguridad cuando se utilizan pequeñas cantidades de sal de paladio. Por un lado, los polvos finos de metal de paladio son pirofóricos debido a la absorción de hidrógeno y, por otro, los propios agentes reductores liberan hidrógeno, como el ácido fórmico, cuyas propiedades de sustancia peligrosa son un reto en sí mismas [59]:
H2[Pd2+Cl4] + H-C2+O-OH→ Pd0 + C4+O2 + 4 HCl
H-CO-OH →CO2 + H2 (¡reacción catalizada por paladio!).
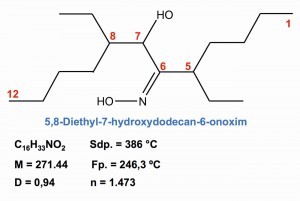 Fig. 29: Extracción de paladio con oximas En la separación selectiva de paladio de otros metales, las extracciones con oximas y dialquil tioéteres han adquirido cada vez más importancia. Un producto químico de extracción especialmente desarrollado para el paladio es la 5,8-dietil-7-hidroxidodecano-6-onoxima, cuya estructura molecular formal y propiedades se muestran en la figura 29 .
Fig. 29: Extracción de paladio con oximas En la separación selectiva de paladio de otros metales, las extracciones con oximas y dialquil tioéteres han adquirido cada vez más importancia. Un producto químico de extracción especialmente desarrollado para el paladio es la 5,8-dietil-7-hidroxidodecano-6-onoxima, cuya estructura molecular formal y propiedades se muestran en la figura 29 .
Entre los di-n-alquil tioéteres, los di-n-hexil y di-n-octil tioéteres se utilizan principalmente en la industria. Como puede verse en la Tabla 1, la solubilidad en la serie de tioéteres disminuye con el aumento del peso molecular; por otra parte, los puntos de inflamación se encuentran en el intervalo seguro con pesos moleculares elevados.
Tras la reextracción con ácido clorhídrico concentrado, vuelve a estar presente el tetracloridopaladato(II), que se precipita con amoníaco como [Pd(NH3)2Cl2] y se calcina.
8 El futuro del paladio
El paladio se ha convertido en la "estrella brillante" entre los metales para los inversores, que han podido esperar tasas de crecimiento del valor de dos dígitos en los últimos años. El aumento de la demanda, las normas medioambientales más estrictas para los vehículos en China y el cambio de los coches diésel a los de gasolina en Europa apuntan a un futuro halagüeño para el paladio. La limitada producción de paladio, unida a la escasez de oferta de los últimos años, también puede impulsar aún más los precios.
Las previsiones positivas se extienden hasta 2024, cuando se espera que el precio del paladio alcance los 3400 USD/troz (31,1 g) [60].
Otros analistas bursátiles ven en la caída de la industria automovilística mundial el fin del auge del paladio. Dado que casi el 85% del paladio extraído en todo el mundo acaba en los catalizadores de los vehículos de gasolina, la demanda de este metal precioso ha caído drásticamente debido a la práctica paralización del mercado automovilístico durante el cierre por coronavirus. Hasta ahora, el precio del paladio sólo se ha recuperado ligeramente de la brusca caída de 2.800 a 1.600 dólares la onza troy.
Es probable que los temores a que se necesite menos paladio debido al aumento de los coches eléctricos sean infundados por el momento. A pesar de las subvenciones, el mercado de vehículos impulsados por baterías está despegando muy lentamente. El futuro de los vehículos híbridos parece más prometedor. E incluso requieren entre un 10 % y un 15 % más de paladio que los vehículos convencionales [61].
Bibliografía
[1] Weeks, M.E.: Discovery of the Elements, Journal of Chemical Education, 6ª ed. (1956) 409
[2] https://de.wikipedia.org/wiki/(2)_Pallas
[3] Wollaston, W.H.: On a New Metal, Found in Crude Platina, Phil. Trans. R. Soc. 94 (1804) 419-430
[4] Graham, Th.: Sobre la relación del hidrógeno con el paladio, Proceedings of the Royal Society of London. 17 (1869) 212-220
[5] Phillips, F.C.: Am. Chem. J., 16 (1894) 255-277
[6] Edelmetall-Taschenbuch, Degussa (1967) 72
[7] http://forkat.anorg.chemie.tu-muenchen.de/biblio/texte/pdf
[8] Libro de bolsillo sobre metales preciosos, Degussa, Hüthig (1995)
[9] https://www.wotech-technical-media.de/womag/ausgabe/2013/10/21_w_edelmetalle_schade_10j2013/21.php
[10] Libro de bolsillo sobre metales preciosos, Degussa (1967) 70
[11] https://de.wikipedia.org/wiki/Platinmetalle/Tabellen_und_Grafiken
[12] https://de.wikipedia.org/wiki/Palladium
[13] Holleman; Wiberg: Inorganic Chemistry, vol. 2, 103ª ed. (2017) 2039
[14] https://de.wikipedia.org/wiki/Thioether
[15] https://www.kettner-edelmetalle.de/Palladium
[16] https://www.scheideanstalt.de/aktuelle-ankaufskurse/palladium/
[17] https://www.handelsblatt.com/finanzen/maerkte/devisen-rohstoffe/rohstoffe-warum-der-palladium-preis-seit-jahresbeginn-explodiert/
[18] https://feingoldhandel.de/palladium-das-silberweisse-edelmetall
[19] Aston, J.G.; Mitacek, P., Jr: Structure of hydrides of palladium, Nature, London, UK, 195 (1962) 70-71
[20] https://www.pv-magazine.de/2017/09/01/solarstrom-wirtschaftlich-in-wasserstoff-umwandeln/
[21] https://www.seilnacht.com/Lexikon/swasser.html
[22] https://de.wikipedia.org/wiki/Anthrachinon-Verfahren
[23] Kickelbick, G.: Química para ingenieros, Pearson Alemania, (2008) 155
[24] https://de.wikipedia.org/wiki/Herbert_Lindlar
[25] Rosenmund, K.W.: Über eine neue Methode zur Darstellung von Aldehyden, 1. Mitteilung, Berichte der deutschen chemischen Gesellschaft. 51 (1918) 585-593
[26] Steinborn, D.: Fundamentals of organometallic complex catalysis, Teubner, Wiesbaden (2007) 283-292
[27] https://www.chemhui.com/pro/37668
[28] Yang, J.; Liu, J.; Neumann, H.; Franke, R.; Jackstell, R.; Beller, M.: Direct synthesis of adipic acid esters via palladium-catalyzed carbonylation of 1,3-dienes, Science, 366 (2019) 1514
[29] https://goetze-gold.de/halbzeuge-zuschnitt/blech/platin-und-palladium/
[30] https://www.wegold.de/produkte/legierungen/palladium-basis-legierungen/676-wegold-dg-dentallegierung
[31] https://de.wikipedia.org/wiki/Dentallegierungen
[32] https://www.edelmetalle.org/medizintechnik/
[33] https://www.aerogen.com/de/technologie/
[34] https://patents.google.com/patent/DE60003490T2/de
[35] https://www.edelmetalle.org/elektronik/
[36] Buth, M.A.: Palladium from PC and electronics, volumen especial, adrenalinemedia (2012)
[37] RÖMPP, Lexikon Chemie, 8ª edición, vol. 4 (1985) 2973
[38] https://de.wikipedia.org/wiki/Ilja_Iljitsch_Tschernjajew
[39] https://de.wikipedia.org/wiki/Trans-Effekt
[40] Tanaka, M.: Structure of Bis(tri-tert-butylphosphine)palladium(0), Acta Cryst., C48 (1992) 739-740
[41] He, L.-Y.: Bis(tri-tert-butilfosfina)paladio(0) [Pd(t-Bu3P)2], Synlett, 26/6 (2015) 551-852
[42] https://shop.jentner.de/galvanische-elektrolyte/edelmetall-elektrolyte/Palladiumbad/
[43] Talgner, F., Myers, M.; Schmidt, H.: Galvanic silver-palladium as a contact surface, Galvanotechnik, Leuze-Verl., 05 (2017) 910
[44] Hasenpusch, W.: Explosivität von Tetramminmetall-nitraten, J. prakt. Chem, Chemiker-Zeitung 335 (1993) 193-196
[45] Chemiker-Fachausschuss d. Gesellschaft Metall und Erz: Analyse der Metalle I: Schiedsverfahren, Springer-Verl., Berlín (1942) 184
[46] Burger, K., Dyrssen, D.; Johansson, L.; Norén, B.; Munch-Petersen, J.: On the Complex Formation of Palladium with Dimethylglyoxime, Acta Chemica Scandinavica, 17 (1963) 1489
[47] Fries, J.; Getrost,H.: Merck, E., Darmstadt: Organische Reagenzien für die Spurenanalyse" (1975) 285
[48] https://en.wikipedia.org/wiki/Palladium(II)_bis(acetilacetonato)
[49] Setsune, J.: Palladium chemistry in recent porphyrin research Journal of Porphyrins and Phthalocyanines, 08/01(2004) 93-102
[50] To, W.; Liu, Y.; Lau, T.; Che, C.: A Robust Palladium(II)-Porphyrin Complex as Catalyst for Visible Light Induced Oxidative C-H Functionalisation, Chemistry - A European Journal, 19/18 (2013).
[51] https://www.umweltbundesamt.de/platin-palladium#hinweise-zum-Recycling
[52] https://www.bmu.de/fileadmin/Daten_BMU/Pools/Forschungsdatenbank/fkz_3711_93_339_substitutionspotenziale_Metalle_bf.pdf
[53] Precious Metals Pocketbook, Degussa AG, Frankfurt, Hüthig- Verl. Heidelberg (1995) 48
[54] Libro de datos Doduco, Pforzheim (1974) 351
[55] Bertau, M.; Müller, A.; Fröhlich, P.; Katzberg, M.: Industrielle Anorganische Chemie, 4ª edición, Wiley-Verl., Weinheim (2013) 363-371
[56] Investigación y desarrollo de metales, Degussa AG (1991) 33-44
[57] Actas del Seminario Anual del Instituto Internacional de Metales Preciosos, IPMI, EE.UU.
[58] Knothe, M.; Hasenpusch, W.: The formation of explosive chlorine-nitrogen compounds during the processes of precious metals separation, Journal of Hazardous Materials, 56 (1997) 137-148
[59] https://de.wikipedia.org/wiki/Ameisensaeure
[60] https://capital.com/de/palladium-preisentwicklung
[61] https://www.boerseonline.de/nachrichten/rohstoffe/voruebergehende-flaute-warum-der-palladium-preis-bald-wieder-steigen-duerfte-102934254