1 Das Edelmetall Osmium
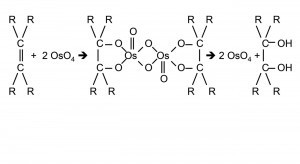
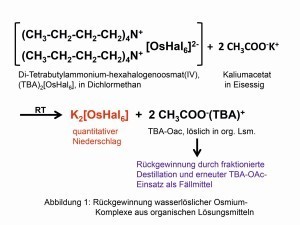 Abb. 1: Rückgewinnung wasserlöslicher Osmium-Komplexe aus organischen LösungsmittelnDas Metall mit der höchsten Dichte von 22,59 g/cm3 bei Raumtemperatur (RT) entdeckte der spätere Cambridge- Professor Smithson Tennant (1761-1815) bereits 1804 zusammen mit dem Iridium im unlöslichen Rückstand nach dem Aufschluss von Platin in Königswasser:
Abb. 1: Rückgewinnung wasserlöslicher Osmium-Komplexe aus organischen LösungsmittelnDas Metall mit der höchsten Dichte von 22,59 g/cm3 bei Raumtemperatur (RT) entdeckte der spätere Cambridge- Professor Smithson Tennant (1761-1815) bereits 1804 zusammen mit dem Iridium im unlöslichen Rückstand nach dem Aufschluss von Platin in Königswasser:
Pt(Os, Ir) + 8 HCl + 2 HNO3 → H2[PtCl6] + (Os, Ir) + 2 NOCl + 4 H2O
Seinen Namen hat das Osmium dem rettichartigen Geruch (osmē, griech. = Geruch, Gestank“) seines in geringer Konzentration vorhandenen flüchtigen Tetroxids, OsO4, zu verdanken [1].
Osmium fällt gemeinsam mit den anderen Platingruppenmetallen (PGM) an. Seine Konzentration in der Erdkruste wird mit 0,0015 ppm zitiert, was noch leicht über den Metallen Platin, Iridium und Gold liegt.
Derzeit befinden sich global etwa 500 kg Osmium in Anreicherungs- und Fertigungsprozessen. Von den bisher geschätzten 9 m3 dieses Edelmetalls lassen sich nur rund 2 m3 als Element gewinnen. Das wären 44 t mit einen derzeitigen Wert von ca. 48 Mrd. Euro. So müssen 10.000 t PGM-Erz in vielen Schritten bearbeitet werden, um schließlich an eine Unze, 31,1 g, Osmium-Metall zu gelangen, mit den Abmessungen eines Würfelzuckers [2].
Insgesamt sind weltweit bis 2017 mehr als 200 Fundorte für gediegenes Osmium und seine Varietäten mit Platin und Iridium bekannt geworden [3].
Allerdings ist das Recycling industrieller Osmium-Abfälle von geringer Bedeutung. Es fällt am Ende des PGM-Trennungsgangs an, wo die Metalle Osmium und Ruthenium sich in einer Peroxid-Schmelze lösen, um danach mit Chlor oder Natriumchorat, NaClO3, in die flüchtigen Tetroxide überführt zu werden.
 Abb. 2: Reines Osmium-Metall hergestellt durch Transportreaktion mit Chlor Einige Nickel-, Chrom-, Kupfer- und Eisenerzlagerstätten in Russland, Kanada oder Südafrika enthalten Osmium in sehr geringen Mengen. Ebenso findet man es in Sedimenten wie Sand oder Kies, etwa in Russland, Äthiopien, Kolumbien oder auf Borneo. Die weltweit größte Abbaustätte ist Witwatersrand in Südafrika. Große Reserven befinden sich in der Türkei und in Bulgarien. Da sich in alkoholischer Natronlauge nur das Osmiumtetroxid als Osmat(VI) löst, lässt es sich vom Ruthenium abtrennen:
Abb. 2: Reines Osmium-Metall hergestellt durch Transportreaktion mit Chlor Einige Nickel-, Chrom-, Kupfer- und Eisenerzlagerstätten in Russland, Kanada oder Südafrika enthalten Osmium in sehr geringen Mengen. Ebenso findet man es in Sedimenten wie Sand oder Kies, etwa in Russland, Äthiopien, Kolumbien oder auf Borneo. Die weltweit größte Abbaustätte ist Witwatersrand in Südafrika. Große Reserven befinden sich in der Türkei und in Bulgarien. Da sich in alkoholischer Natronlauge nur das Osmiumtetroxid als Osmat(VI) löst, lässt es sich vom Ruthenium abtrennen:
Os(XIII)O4 + 2 NaOH + CH3-CH2-OH → Na2Os(VI)O4 + CH3-CH=O + H2O
Zur Herstellung des reinen Osmium-Metalls stehen mehrere Möglichkeiten zur Verfügung: Aus dem Osmat(VI) sind zum einen quantitative Fällungen mit Ammoniumchlorid oder nach der Umsetzung mit Salzsäure und großen organischen Ammonium-Kationen möglich:
A. Na2OsO4 + 4 NH4Cl → [OsO2(NH3)4]Cl2 + 2 NaCl + 2 H2O
B. Na2OsO4 + 10 HCl → H2[OsCl6] + Cl2 + 2 NaCl + 4 H2O
H2[Os(IV)Cl6] + NR4 → (R4N)2[OsCl6].
Schwerlösliche Hexahalogeno-osmate(IV) sind mit diversen Onium-Kationen präparierbar, wie Tetrabutylammonium (TBA), organische Diammonium-Verbindungen oder Alkalimetall-Kationen in makrocyclischen Kronenethern [4].
 Abb. 3: Die sieben Isotopen des OsmiumsDie schwerlöslichen Hexahalogeno-Komplexe mit organischen Ammonium-Kationen sind über „reziproke Fällungen“ in organischen Lösungsmittteln mittels organischer Alkalimetallsalze wieder in wasserlösliche Verbindungen zurückzuführen (Abb. 1). Eine Methode, die das Vernichten zahlloser Nujol- und Tabletten-Präparate zwecks spektroskopischer Untersuchungen beendete [4].
Abb. 3: Die sieben Isotopen des OsmiumsDie schwerlöslichen Hexahalogeno-Komplexe mit organischen Ammonium-Kationen sind über „reziproke Fällungen“ in organischen Lösungsmittteln mittels organischer Alkalimetallsalze wieder in wasserlösliche Verbindungen zurückzuführen (Abb. 1). Eine Methode, die das Vernichten zahlloser Nujol- und Tabletten-Präparate zwecks spektroskopischer Untersuchungen beendete [4].
Hochreines Osmium ist beispielsweise über Transport- Reaktionen in Halogen-Atmosphäre zugängig (Abb. 2). Der Siedepunkt von Osmiumtetrachlorid, OsCl4, liegt bereits bei 450 °C.
Das Molekulargewicht des Osmiums mit 190,23 g/Mol resultiert aus sieben Isotopen, von denen fünf stabil sind. Der radioaktive Zerfall der in geringen Konzentrationen enthaltenen Isotopen Os-184 und -186 ist durch sehr lange Halbwertszeiten gekennzeichnet (Abb. 3).
Der Weltmarkt für Osmium ist überschaubar. Würde man die knapp 100 Kilogramm Osmium, die pro Jahr weltweit gehandelt werden, zu einer Kugel formen, wäre sie aufgrund der hohen Dichte des Elements nicht größer als ein Handball. Es wird vorrangig als verarbeitete Verbindung gehandelt, vor allem in Form des Osmiumtetroxids in versiegelten Glasampullen [5].
2 Ein Metall mit außergewöhnlichen Eigenschaften
Das reine Metall besticht durch einen intensiven stahl- blauen metallischen Glanz. Mit knappem Vorsprung vor Iridium ist Osmium das Element mit der höchsten Dichte aller natürlich vorkommenden Elemente. Nach beiden Seiten im Periodensystem verringern sich die Dichten der Nachbar-Metalle (Abb. 4).
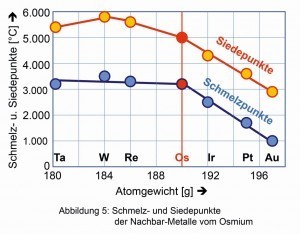
Unter den PGM weist Osmium den höchsten Schmelz- und Siedepunkte auf, wird allerdings von den Nachbarn Rhenium, Wolfram und Tantal übertrumpft (Abb. 5).
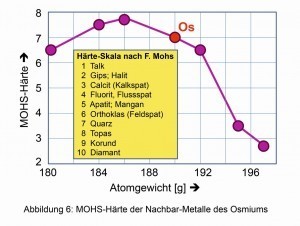
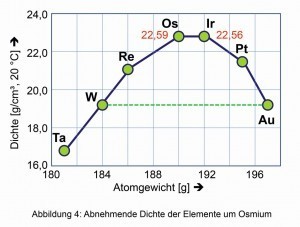 Abb. 4: Abnehmende Dichte der Elemente um OsmiumÄhnliches gilt für die von bestimmten Mineralien abgeleitete Vergleichshärte nach dem deutschen Mineralogen Friedrich Mohs (1773–1839) (Abb. 6). Auch der Kompressions-Modul von 462 Giga-Pascal, die spontan elastische Veränderung des Volumens und damit der Dichte unter Anwendung isostatischen Drucks, ist einer der höchsten unter allen bekannten Elementen und Verbindungen. Sogar der harte Diamant ist mit 443 GPa etwas leichter komprimierbar.
Abb. 4: Abnehmende Dichte der Elemente um OsmiumÄhnliches gilt für die von bestimmten Mineralien abgeleitete Vergleichshärte nach dem deutschen Mineralogen Friedrich Mohs (1773–1839) (Abb. 6). Auch der Kompressions-Modul von 462 Giga-Pascal, die spontan elastische Veränderung des Volumens und damit der Dichte unter Anwendung isostatischen Drucks, ist einer der höchsten unter allen bekannten Elementen und Verbindungen. Sogar der harte Diamant ist mit 443 GPa etwas leichter komprimierbar.
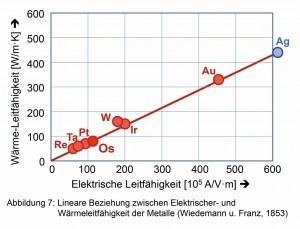
Thermische- und elektrische Leitfähigkeit reichen bei Weitem nicht an die Werte von Gold und Silber heran, liegen jedoch in diesen Eigenschaften in der Nähe des Platins. Auch das empirische „Wiedemann-Franz-Gesetz“ [6], das von der linearen Beziehung zwischen thermischer- und elektrischer Leitfähigkeit ausgeht, zeigt sich als gut erfüllt (Abb. 7).
Als Edelmetall reagiert Osmium gegenüber Aufschluss- Chemikalien relativ träge. Selbst Königswasser (HCl/HNO3-3:1) vermag reines Osmium kaum zu lösen. Nur sehr starke Oxidationsmittel wie konzentrierte Salpetersäure, heiße Schwefelsäure oder alkalische Oxidations- Schmelzen, wie Natriumperoxid und Kaliumchlorat greifen das Osmium an.
Fein verteiltes Metall, etwa chemisch gefälltes Osmium- Pulver, verbreitet an der Luft einen dem Chlor ähnlichen Geruch und bewirkt auch Halo-Effekte beim Sehen, wie beim einstündigen Schwimmen im Hallenbad ohne Schwimmbrille.
Osmiumtetroxid und alle Osmium-Verbindungen gelten als sehr giftig. Sie können bis zum Lungenödem führen sowie Haut- und Augenschäden auslösen. Der entsprechende Arbeitsgrenzwert, AGW, liegt mit 0,002 mg/m3 daher extrem niedrig.
Nicht vergessen werden darf auch die Selbst-Entzündung, ja sogar Selbst-Explosion von chemisch gefälltem Osmium-Pulver. Es vermag, wie auch das Ruthenium-Pulver, über 1.600 Volumenteile Wasserstoff pro Volumenteil Metallpulver aus den Reduktions-Chemikalien, besonders Natriumboranat, NaBH4, einzulagern und kann daher extrem explosiv wirken, wenn das Pulver nicht bei über 600 °C im Stickstoffstrom entgast wurde.
3 Verwendungen des Osmiums
Die Anwendungsbreite ist auf Grund der schweren Bearbeitbarkeit und des hohen Preises auf wenige technische Einsatzbereiche beschränkt. Vorbei sind die Zeiten, da die spröden und aufwändig fabrizierbaren Lampen mit Osmium- und Wolfram-Wendel ausgestattet wurden und seit 1905 dank der Fa. Osram die Straßen und Stuben erhellten. Heute zählen spezielle Legierungen, der Einsatz als Katalysator sowie die Schmuckverarbeitung und Wert-Anlage zu den Hauptverwendungs-Bereichen.
3.1 Legierungen
 Abb. 8: Ring aus Osmium (5 g) und Spitze eines Füllfederhalters aus einer Osmiumlegierung Aufgrund der hohen Giftigkeit der Oxide wird Osmium in technischen Anwendungen selten in reinem Zustand verwendet. Beim Einsatz in abrasiven und verschleißenden Verfahren, wie bei Schreibkugeln in Kugelschreibern, exklusiven Füllfederspitzen (Abb. 8), phonografischen Abtastnadeln, Wellen und Zapfen im Instrumentenbau sowie bei elektrischen Kontakten (Abb. 9) kommen harte Osmium-haltige Legierungen der Platinmetalle zum gelegentlichen Einsatz, beispielsweise als Iridium-Osmium-Legierungen, eine Kombination, die auch in der Natur vorkommt [7–9].
Abb. 8: Ring aus Osmium (5 g) und Spitze eines Füllfederhalters aus einer Osmiumlegierung Aufgrund der hohen Giftigkeit der Oxide wird Osmium in technischen Anwendungen selten in reinem Zustand verwendet. Beim Einsatz in abrasiven und verschleißenden Verfahren, wie bei Schreibkugeln in Kugelschreibern, exklusiven Füllfederspitzen (Abb. 8), phonografischen Abtastnadeln, Wellen und Zapfen im Instrumentenbau sowie bei elektrischen Kontakten (Abb. 9) kommen harte Osmium-haltige Legierungen der Platinmetalle zum gelegentlichen Einsatz, beispielsweise als Iridium-Osmium-Legierungen, eine Kombination, die auch in der Natur vorkommt [7–9].
Eine Legierung aus 90 % Platin und 10 % Osmium ist in medizinischen Implantaten und künstlichen Herzklappen sowie in Herzschrittmachern zu finden [1].
3.2 Katalyse
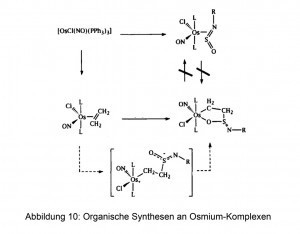
Osmium kann ebenfalls als leistungsstarker Katalysator bei der Reaktion von Gasen eingesetzt werden. Im Einsatz befinden sich Hydrier-Katalysatoren aus Osmium-Legierungen. Einige Osmium-Verbindungen in Form von Feststoffen oder Lösungen dienen als Katalysatoren für die Synthese von Feinchemikalien sowie von organometallischen Präparaten (Abb. 10).
In der organischen Chemie sind Dihydroxylierungs-Reaktionen schon lange im Einsatz (Abb. 11). Zu den bekanntesten zählt die sogenannte „Upjohn-Dihydroxylierung“ mit katalytisch eingesetztem Osmiumtetroxid, OsO4, und N-Methylmorpholin-N-oxid (NMO). Für die nach ihrem Entdecker Barry Sharpless benannte stereoselektive „Sharpless-Dihydroxylierung“ wurde 2001 der Nobelpreis für Chemie vergeben [10–12].
3.3 Schmuck und Wert-Anlage
Lange Zeit befand sich die Vermarktung des Osmium- Metalls vergleichsweise im Dornröschenschlaf, wenn man es mit der Bedeutung der übrigen Edelmetalle vergleicht. Osmium-Pulver und -Schwämme, so wie sie in den Trennungsgängen der Scheide-Anstalten seit ihrer Entdeckung im Jahr 1804 anfielen, setzten an ihren großen Oberflächen durch Reaktion mit dem Luft-Sauerstoff deutlich vernehmbare, unangenehm riechende und sehr giftige OsO4-Gase frei.
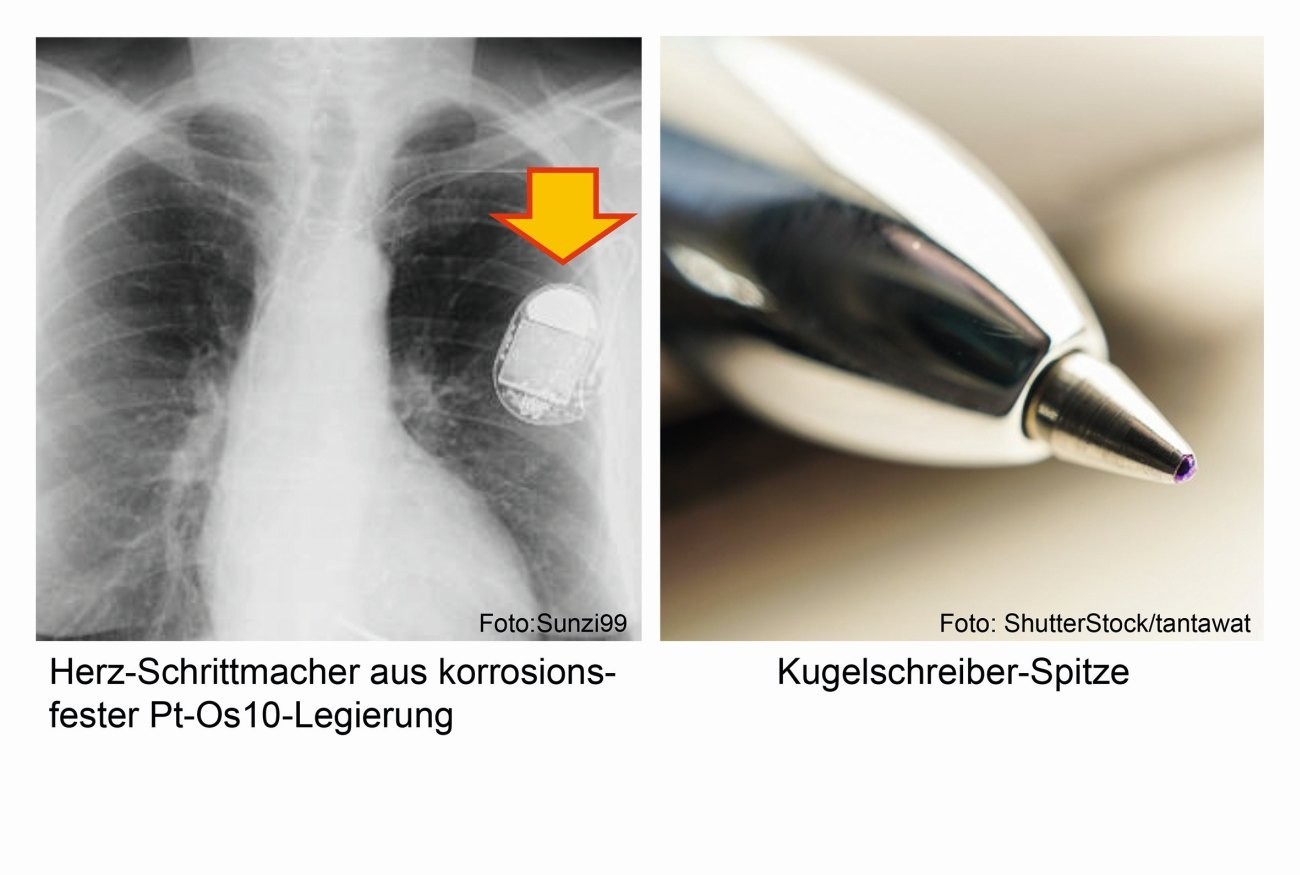 Abb. 9: Anwendungsbeispiele von Osmiumlegierungen
Abb. 9: Anwendungsbeispiele von Osmiumlegierungen
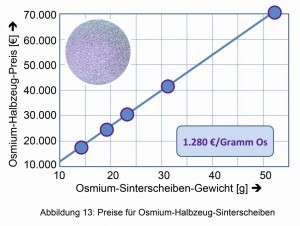
Das änderte sich mit der Herstellung und Bearbeitung kristallinen Osmium-Metalls im Jahr 2013 und seiner Vermarktung als Schmuck- und Anlagemetall (Abb. 12) durch das neu gegründete „Osmium-Institute“ in Baierbrunn [13]. Seit dem Durchbruch in der Kristallisation explodierte der Preis von knapp 13 Euro für ein Gramm Osmium auf über 400 Euro. Im Juni 2019 lag der Osmium- Preis im Kleinmengen-Bereich bei 1.280 €/Gramm Os (Abb. 13).
4 Chemische Osmium-Analysen
Neben den modernen Analysen-Methoden in der Forschung und Industrie, wie Atomabsorption (AAS), Induced Cuppled Plasma (ICP) oder Röntgenfluoreszenz-Analyse (RFA) sind zum Teil auch noch klassische photometrische und quantitative Präzipitations-Prozesse mit organischen Reagenzien im Einsatz [14]. Da eine Reihe anderer Elemente stören, empfiehlt sich die vorherige Abtrennung als Osmiumtetroxid, OsO4.
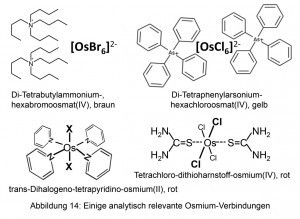
Bereits 1918 schlug der Moskauer Chemiker Lew Alexandrowitsch Tschugajew (1873–1922) Thioharnstoff zum Nachweis dieses Elementes vor. Unter definierten Arbeitsbedingungen entsteht eine charakteristische Rotfärbung, während das Ruthenium eine blaue Farbe entstehen lässt.
Zur quantitativen Fällung von Hexahalogenoosmaten(IV) eigenen sich quartäre Alkyl- und Arylammonium-Kationen sowie auch das Tetraphenylarsonium-Kation.
Sehr schwer löslich zeigt sich auch das neutrale Tetrapyridino-dihalogeno-osmium(II). Es ist beispielsweise durch Kochen der Hexahalogenoosmate(IV) in Pyridin mit Glyzerin zugängig (Abb. 14).
Etwas aufwendiger gestalten sich die Isotopen-Analysen: 186Os ist ein natürlicher Alpha-Strahler mit einer Halbwertszeit von 2,0 x 1015 Jahren. Durch Beta-Strahlung des Rhenium-Isotops 187Re entsteht das stabile Isotop 187Os. Bei hohen geologischen Rhenium-Gehalten in den Lagerstätten lässt sich das 187Os/ 186Os-Verhältnis geochronologisch nutzen [15].
5 Os-Tetroxid und Os-Verbindungen
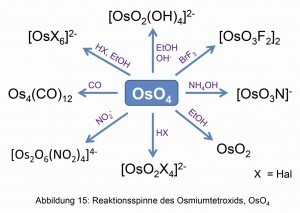
Durch die praktische Oxidierbarkeit des Osmiums zum Tetroxid, OsO4, und dem niedrigen Siedepunkt starten die meisten anderen Osmium-Verbindungen aus dem Osmiumtetroxid (Abb. 15).
Osmium(VIII)-oxid wird aus dem Osmium-Metall durch Oxidation von Osmiumlösungen mit Salpetersäure oder Natriumperoxodisulfat in Schwefelsäure hergestellt. Wegen der Flüchtigkeit und Giftigkeit kommt es in Ampullen eingeschmolzen in den Handel [16].
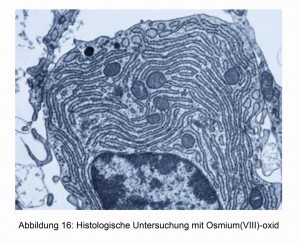
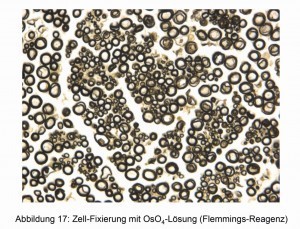
Neben den bereits beschriebenen Anwendungen findet das OsO4 besonders bei histologischen Untersuchungen seine Anwendung [17]. Die Zellränder nehmen verschiedene Färbungen an und sind dadurch unter dem Lichtmikroskop gut zu erkennen. Zwei Beispiele zeigen die Abbildungen 16 und 17.
In Wasser ist die Verbindung nur wenig löslich, in Tetrachlorkohlenstoff, CCl4, jedoch sehr gut.
Durch photochemische Reaktionen können sich aus den halogenierten Kohlenwasserstoffen die Halogenid-Ionen als Ligand an das Osmium anlagern [18].
Mit Halogensäuren, wie z. B. Salzsäure setzt sich das Osmium(VIII)-oxid schnell zum Hexahalogeno-osmat(IV) nach der folgenden Gleichung um:
OsO4 + 10 HCl → H2[OsCl6] + 2 Cl2 + 4 H2O.
Durch Fällung aus konzentrierten Lösungen von Kalium-hexachloro-osmat(IV), K2OsCl6, mit konzentrierter Salzsäure werden homogene Mischkristalle in allen beliebigen Mischungsverhältnissen erhalten [19]. Der Gang der Gitterkonstanten folgt der „Vegard’schen Regel“. Diese Regel beschreibt die lineare Abhängigkeit der Gitterkonstanten eines Substitutionsmischkristalls bzw. einer Legierung vom prozentualen Anteil der Komponenten [20].
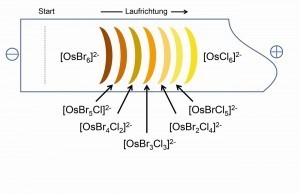
Bei der unvollständigen Umsetzung von K2[OsCl6] in HBr entsteht die Reihe der sieben Gemischtligand-Komplexe vom Typ K2[OsClxBr6-x], die mit Hilfe der Elektrophorese in ihren typischen Farben beim Lauf zur Kathode separat sichtbar werden (Abb. 18) und auch präparativ zugängig sind. Auf diese Weise ist eine Fülle von Gemischtligand-Komplexen mit diversen anorganischen und organischen Liganden zugängig [21].
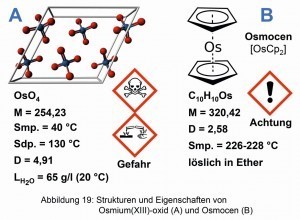
Eine interessante Osmium-Verbindung ist das Osmocen. Es wurde zuerst durch Ernst Otto Fischer (1918–2008) und Heinrich Grumbert, ausgehend vom OsO4 synthetisiert [22]. Gemeinsam mit Geoffrey Wilkinson erhielt Fischer für die Arbeiten an organometallischen „Sandwich-Verbindungen“ 1973 den Nobelpreis für Chemie [23]. Anwendungen zur photokatalytischen Wasser-Zersetzung sollen mit Osmocen recht erfolgreich verlaufen [24]. Abbildung 19 verweist auf die Strukturen und Eigenschaften des Osmium(IV)-oxids und des Osmocens.
Trotz der zum Teil thermodynamisch und kinetisch recht stabilen Osmium-Präparate sind nur relativ wenige Verbindungen mit chemischen und physikalischen Daten belegt. Das mag auch an den teuren Ausgangsstoffen und den überschaubaren Anwendungen dieses Elements liegen.
Literatur
[1] https://de.wikipedia.org/wiki/Osmium
[2] Wolf, I.: Kristallines Osmium, das seltenste Edelmetall der Erde, Osmium-Institut, Vortrag auf der Invest 2019, https://www.insignitus.com/de/blog/kristallines-osmium-das-seltenste-und-dichteste-edelmetall-der-erde/
[3] Fundortliste für Osmium beim Mineralienatlas und bei Mindat
[4] Hasenpusch, W.: Dissertation, Universität Kiel, 1976
[5] https://www.brandeins.de/magazine/brand-eins-wirtschaftsmagazin/2016/intuition/osmium-os
[6] https://www.chemie-schule.de/KnowHow/Wiedemann-Franzsches_Gesetz
[7] https://www.heraeus.com/en/hch/products_and_solutions_chemicals/chemical_products/pgm_solutions_pc/os_pc/osmium_page_pc.html
[8] https://www.chemicool.com/elements/osmium.html
[9] https://www.azom.com/article.aspx?ArticleID=1842
[10] https://de.wikipedia.org/wiki/Dihydroxylierung
[11] https://www.technology.matthey.com/article/18/3/94-96
[12] Hill, A.F.: Organotransition Metallic Chemistry of Sulfur Dioxide Analogs, Advances in Organometallic Chemistry, 1994
[13] www.osmium-institute.com; https://www.buy-osmium.com/de/barren/disk/
[14] MERCK, Darmstadt: Organische Reagenzien für die Spurenanalyse, Osmium, 1975
[15] Faure, G.: Priciples of Isotope Geology, Wiley, N.Y. (1977), 2. Ed. (1986) 608 pages, RÖMPP Osmium
[16] https://de.wikipedia.org/wiki/Osmium(VIII)-oxid
[17] https://www.chemistryworld.com/podcasts/osmium-tetraoxide/7656.article
[18] Hasenpusch, W.; Preetz, W.: Photochemischer Ligandenaustausch an Hexahalogenoosmaten(IV), ZAAC, 432 (1977) 107–114
[19] Müller, H.; Rödl, M.: Das Mischkristallsystem K2OsCl6, ZAAC, 608 (1992) 145–146
[20] https://de.wikipedia.org/wiki/Vegardsche_Regel
[21] Preetz, W., Blasius, E.: Gemischtligandkomplexe, I. Allgemeine und theoretische Betrachtungen über Bildung von Gemischtligandkomplexen und ionophoretische Trennmöglichkeiten, 332 (1964) 140–148
[22] https://de.wikipedia.org/wiki/Osmocen
[23] https://de.wikipedia.org/wiki/Ernst_Otto_Fischer
[24] Kunkely, H.; Vogler, A.: Wasserspaltung durch Licht mit Osmocen als Photokatalysator, Angew. Chem, 121(2009) 1713–5