De los seis metales del grupo del platino, el platino, el paladio, el iridio, el rodio y el rutenio, el osmio, duro, quebradizo y de color azul acero, se caracteriza por unas propiedades excepcionales: el metal de transición puro del 8º grupo de la tabla periódica tiene el mayor módulo de compresión y la mayor densidad de todos los elementos. Debido a su elevado precio, sus aplicaciones técnicas se limitan a aplicaciones en las que se requiere una dureza y una resistencia a la corrosión extremas. La separación de los demás metales y la mayoría de los métodos analíticos se realizan por destilación oxidativa del óxido de osmio(VIII), OsO4. La mayoría de los derivados proceden de este compuesto, cuyas propiedades termodinámica y cinéticamente estables han dado lugar a numerosas investigaciones químicas y espectroscópicas.
1 El metal precioso osmio
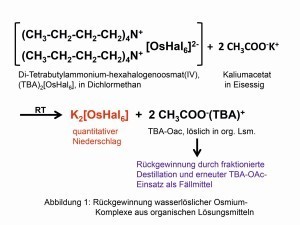 Fig. 1: Recuperación de complejos de osmio solubles en agua a partir de disolventes orgánicosElmetal de mayor densidad, 22,59 g/cm3 a temperatura ambiente (TA), fue descubierto por el posterior profesor de Cambridge Smithson Tennant (1761-1815) ya en 1804 junto con el iridio en el residuo insoluble tras la descomposición del platino en agua regia:
Fig. 1: Recuperación de complejos de osmio solubles en agua a partir de disolventes orgánicosElmetal de mayor densidad, 22,59 g/cm3 a temperatura ambiente (TA), fue descubierto por el posterior profesor de Cambridge Smithson Tennant (1761-1815) ya en 1804 junto con el iridio en el residuo insoluble tras la descomposición del platino en agua regia:
Pt(Os, Ir) + 8 HCl + 2 HNO3 → H2[PtCl6] + (Os, Ir) + 2 NOCl + 4 H2O
El osmio debe su nombre al olor a retinto (osmē, griego = "olor, hedor") de su tetróxido volátil, OsO4, presente en bajas concentraciones [1].
El osmio se encuentra junto con otros metales del grupo del platino (MGP). Su concentración en la corteza terrestre se cifra en 0,0015 ppm, ligeramente superior a la de los metales platino, iridio y oro.
Actualmente hay unos 500 kg de osmio en procesos de enriquecimiento y producción en todo el mundo. De los 9m3 estimados de este metal precioso hasta la fecha, sólo pueden extraerse unos 2m3 como elemento. Esto supondría 44 toneladas con un valor actual de unos 48.000 millones de euros. Así, 10.000 toneladas de mineral de MGP deben procesarse en muchas etapas para obtener finalmente una onza, 31,1 g, de metal de osmio, con las dimensiones de un terrón de azúcar [2].
En 2017, se habían reconocido en todo el mundo un total de más de 200 yacimientos de osmio sólido y sus variedades con platino e iridio [3].
Sin embargo, el reciclaje de los residuos industriales de osmio tiene una importancia menor. Se produce al final del proceso de separación de MGP, en el que los metales osmio y rutenio se disuelven en un fundido de peróxido y luego se convierten en los tetróxidos volátiles con cloro o clorato sódico, NaClO3.
 Fig. 2: Metal de osmio puro producido por reacción de transporte con cloro Algunos yacimientos de níquel, cromo, cobre y mineral de hierro en Rusia, Canadá o Sudáfrica contienen osmio en cantidades muy pequeñas. También se encuentra en sedimentos como arena o grava, por ejemplo en Rusia, Etiopía, Colombia o Borneo. La mayor explotación minera del mundo es la de Witwatersrand, en Sudáfrica. Hay grandes reservas en Turquía y Bulgaria. Como sólo el tetróxido de osmio se disuelve en una solución alcohólica de hidróxido de sodio como osmat(VI), puede separarse del rutenio:
Fig. 2: Metal de osmio puro producido por reacción de transporte con cloro Algunos yacimientos de níquel, cromo, cobre y mineral de hierro en Rusia, Canadá o Sudáfrica contienen osmio en cantidades muy pequeñas. También se encuentra en sedimentos como arena o grava, por ejemplo en Rusia, Etiopía, Colombia o Borneo. La mayor explotación minera del mundo es la de Witwatersrand, en Sudáfrica. Hay grandes reservas en Turquía y Bulgaria. Como sólo el tetróxido de osmio se disuelve en una solución alcohólica de hidróxido de sodio como osmat(VI), puede separarse del rutenio:
Os(XIII)O4 + 2 NaOH + CH3-CH2-OH → Na2Os(VI)O4 + CH3-CH=O+ H2O
Existen varias formas de producir el osmio metálico puro: Por un lado, a partir del osmato(VI) son posibles precipitaciones cuantitativas con cloruro de amonio o tras reacción con ácido clorhídrico y grandes cationes orgánicos de amonio:
A. Na2OsO4 + 4 NH4Cl→ [OsO2(NH3)4]Cl2 + 2 NaCl + 2 H2O
B. Na2OsO4 + 10 HCl → H2[OsCl6] + Cl2 + 2 NaCl + 4 H2O
H2[Os(IV)Cl6] + NR4 → (R4N)2[OsCl6].
El hexahalogeno-osmato(IV) poco soluble puede prepararse con diversos cationes de onio, como el tetrabutilamonio (TBA), compuestos orgánicos de diamonio o cationes de metales alcalinos en éteres corona macrocíclicos [4].
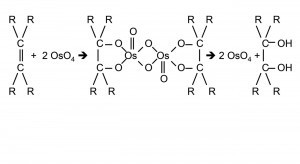
 Fig. 3: Los siete isótopos del osmioLoscomplejos de hexahalogeno poco solubles con cationes orgánicos de amonio pueden volver a convertirse en compuestos solubles en agua mediante "precipitación recíproca" en disolventes orgánicos utilizando sales orgánicas de metales alcalinos (Fig. 1). Este método puso fin a la destrucción de innumerables preparaciones de nujol y pastillas para realizar investigaciones espectroscópicas [4].
Fig. 3: Los siete isótopos del osmioLoscomplejos de hexahalogeno poco solubles con cationes orgánicos de amonio pueden volver a convertirse en compuestos solubles en agua mediante "precipitación recíproca" en disolventes orgánicos utilizando sales orgánicas de metales alcalinos (Fig. 1). Este método puso fin a la destrucción de innumerables preparaciones de nujol y pastillas para realizar investigaciones espectroscópicas [4].
El osmio de gran pureza es accesible, por ejemplo, mediante reacciones de transporte en atmósfera halógena (Fig. 2). El punto de ebullición del tetracloruro de osmio, OsCl4, es ya de 450 °C.
El peso molecular del osmio de 190,23 g/mol es el resultado de siete isótopos, cinco de los cuales son estables. La desintegración radiactiva de los isótopos Os-184 y -186, presentes en bajas concentraciones, se caracteriza por unas vidas medias muy largas (Fig. 3).
El mercado mundial del osmio es manejable. Si se diera forma de pelota a los casi 100 kilogramos de osmio que se comercializan anualmente en todo el mundo, no sería más grande que un balón de balonmano debido a la alta densidad del elemento. Se comercializa principalmente como compuesto procesado, sobre todo en forma de tetróxido de osmio en ampollas de vidrio selladas [5].
2 Un metal con propiedades excepcionales
El metal puro impresiona por su intenso brillo metálico azul acero. El osmio es el elemento con la densidad más alta de todos los elementos naturales, justo por delante del iridio. A ambos lados de la tabla periódica, las densidades de los metales vecinos disminuyen (Fig. 4).
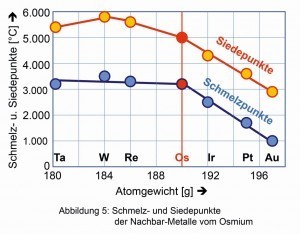
Entre los MGP, el osmio tiene los puntos de fusión y ebullición más altos, pero es superado por sus vecinos el renio, el wolframio y el tántalo (Fig. 5).
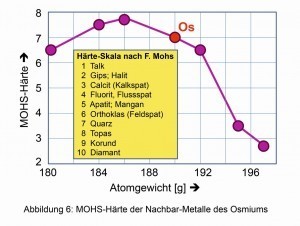
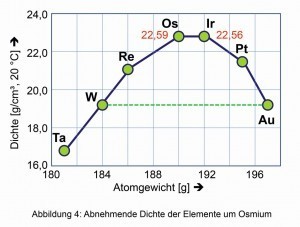 Fig. 4: Densidad decreciente de los elementos en torno al osmioLo mismoocurre con la dureza comparativa derivada de ciertos minerales según el mineralogista alemán Friedrich Mohs (1773-1839) (Fig. 6). El módulo de compresión de 462 giga-pascales, el cambio elástico espontáneo de volumen y, por tanto, de densidad cuando se aplica presión isostática, es también uno de los más altos de todos los elementos y compuestos conocidos. Incluso el diamante duro es ligeramente más fácil de comprimir, con 443 giga-pascales.
Fig. 4: Densidad decreciente de los elementos en torno al osmioLo mismoocurre con la dureza comparativa derivada de ciertos minerales según el mineralogista alemán Friedrich Mohs (1773-1839) (Fig. 6). El módulo de compresión de 462 giga-pascales, el cambio elástico espontáneo de volumen y, por tanto, de densidad cuando se aplica presión isostática, es también uno de los más altos de todos los elementos y compuestos conocidos. Incluso el diamante duro es ligeramente más fácil de comprimir, con 443 giga-pascales.
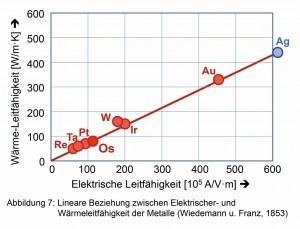
La conductividad térmica y eléctrica no se acercan ni de lejos a los valores del oro y la plata, pero se aproximan al platino en estas propiedades. La "ley de Wiedemann-Franz" empírica [6], que se basa en la relación lineal entre la conductividad térmica y eléctrica, también se cumple bien (Fig. 7).
Como metal precioso, el osmio reacciona con relativa lentitud a los productos químicos de digestión. Incluso el agua regia (HCl/HNO3-3:1) apenas es capaz de disolver el osmio puro. Sólo los agentes oxidantes muy fuertes, como el ácido nítrico concentrado, el ácido sulfúrico caliente o los fundentes alcalinos de oxidación, como el peróxido sódico y el clorato potásico, atacan al osmio.
El metal finamente disperso, como el polvo de osmio precipitado químicamente, difunde un olor similar al del cloro en el aire y también provoca efectos de halo en la visión, como cuando se nada durante una hora en una piscina cubierta sin gafas de natación.
El tetróxido de osmio y todos los compuestos de osmio se consideran muy tóxicos. Pueden provocar edema pulmonar y causar lesiones cutáneas y oculares. Por ello, el valor límite de exposición profesional correspondiente, AGW, es extremadamente bajo: 0,002 mg/m3.
Tampoco hay que olvidar la autoignición e incluso la autoexplosión del polvo de osmio precipitado químicamente. Al igual que el polvo de rutenio, es capaz de almacenar más de 1.600 partes volumétricas de hidrógeno por parte volumétrica de polvo metálico procedente de los productos químicos de reducción, especialmente el boranato sódico, NaBH4, por lo que puede tener un efecto extremadamente explosivo si el polvo no se ha desgasificado a más de 600 °C en una corriente de nitrógeno.
3 Usos del osmio
El abanico de aplicaciones se limita a unos pocos ámbitos técnicos debido a la dificultad de su procesamiento y a su elevado precio. Atrás quedaron los tiempos en que las lámparas, frágiles y costosas de fabricar, se equipaban con filamentos de osmio y tungsteno y, gracias a la empresa Osram, llevan iluminando calles y salones desde 1905. Hoy en día, las aleaciones especiales, el uso como catalizadores y el procesamiento de joyas y la inversión de valor se encuentran entre las principales áreas de uso.
3.1 Aleaciones
 Fig. 8: Anillo de osmio (5 g) y punta de una pluma estilográfica fabricados con una aleación de osmio Debido a la elevada toxicidad de los óxidos, el osmio rara vez se utiliza en estado puro en aplicaciones técnicas. Cuando se utiliza en procesos abrasivos y de desgaste, como las bolas de escritura de los bolígrafos, las puntas exclusivas de las plumas estilográficas (Fig. 8), las agujas de los escáneres fonográficos, los ejes y las clavijas en la fabricación de instrumentos y los contactos eléctricos (Fig. 9), se emplean ocasionalmente aleaciones duras de los metales del platino que contienen osmio, por ejemplo como aleaciones de iridio-osmio, una combinación que también se da en la naturaleza [7-9].
Fig. 8: Anillo de osmio (5 g) y punta de una pluma estilográfica fabricados con una aleación de osmio Debido a la elevada toxicidad de los óxidos, el osmio rara vez se utiliza en estado puro en aplicaciones técnicas. Cuando se utiliza en procesos abrasivos y de desgaste, como las bolas de escritura de los bolígrafos, las puntas exclusivas de las plumas estilográficas (Fig. 8), las agujas de los escáneres fonográficos, los ejes y las clavijas en la fabricación de instrumentos y los contactos eléctricos (Fig. 9), se emplean ocasionalmente aleaciones duras de los metales del platino que contienen osmio, por ejemplo como aleaciones de iridio-osmio, una combinación que también se da en la naturaleza [7-9].
Una aleación con un 90% de platino y un 10% de osmio puede encontrarse en implantes médicos y válvulas cardíacas artificiales, así como en marcapasos [1].
3.2 Catálisis
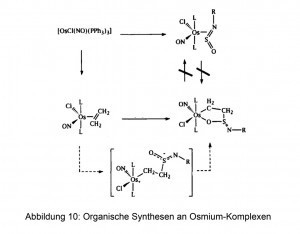
El osmio también puede utilizarse como potente catalizador en la reacción de gases. Se utilizan catalizadores de hidrogenación fabricados con aleaciones de osmio. Algunos compuestos de osmio en forma de sólidos o soluciones se utilizan como catalizadores para la síntesis de química fina y preparados organometálicos (Fig. 10).
Las reacciones de dihidroxilación se utilizan desde hace mucho tiempo en química orgánica (Fig. 11). Una de las más conocidas es la denominada "dihidroxilación Upjohn" con tetróxido de osmio, OsO4, y N-metilmorfolina-N-óxido(NMO) catalizados. La "dihidroxilación de Sharpless" estereoselectiva, que lleva el nombre de su descubridor Barry Sharpless, recibió el Premio Nobel de Química en 2001 [10-12].
3.3 Joyería e inversión de valor
Durante mucho tiempo, la comercialización del osmio metálico estuvo comparativamente aletargada si se compara con la importancia de otros metales preciosos. Los polvos y esponjas de osmio, como los producidos en las vetas de separación de las refinerías desde su descubrimiento en 1804, liberaban en sus grandes superficies gases de OsO4 claramente audibles, de olor desagradable y muy tóxicos por reacción con el oxígeno atmosférico.
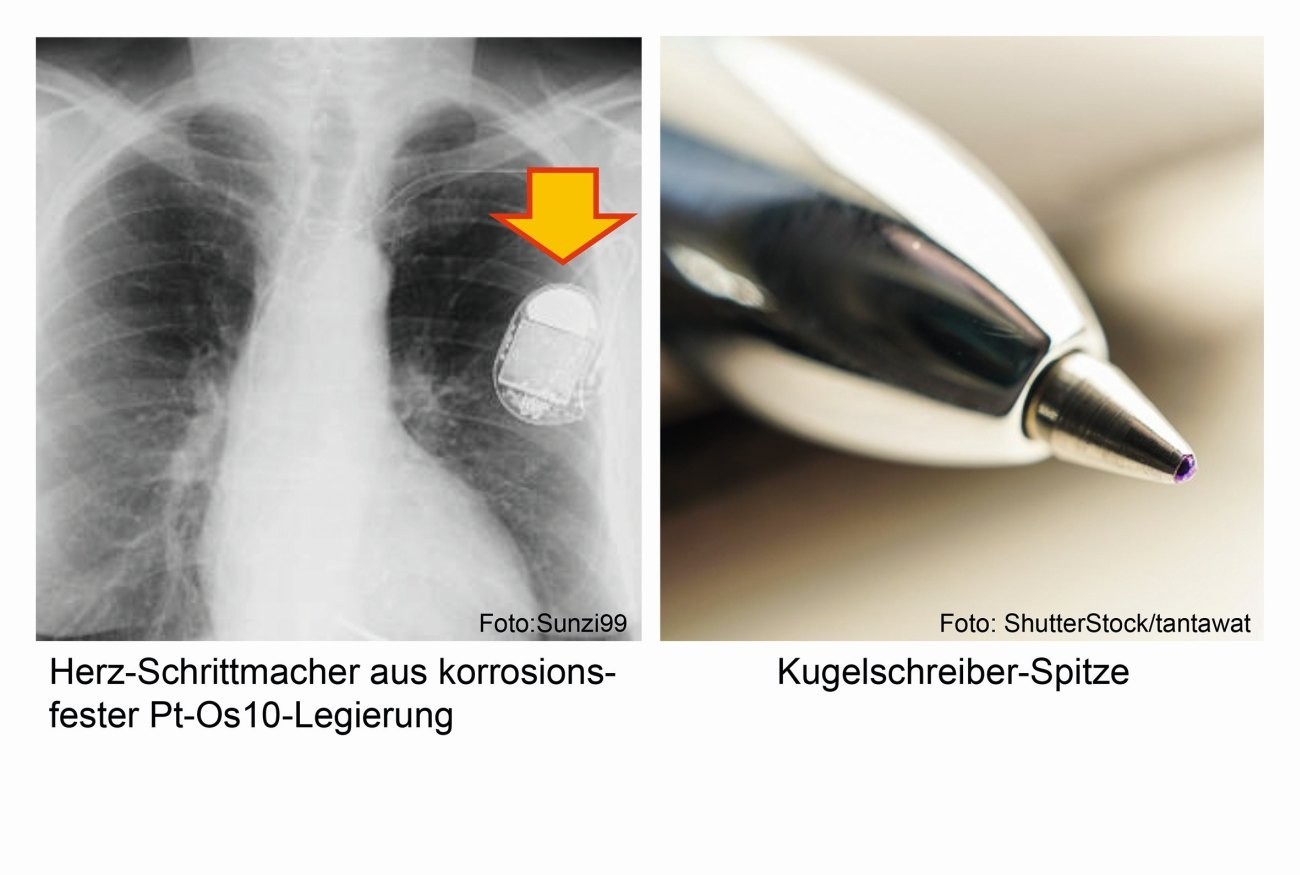 Fig. 9: Ejemplos de aplicaciones de las aleaciones de osmio
Fig. 9: Ejemplos de aplicaciones de las aleaciones de osmio
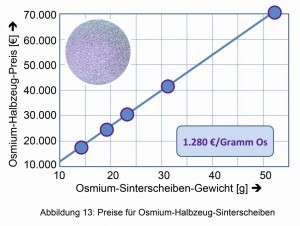
Esto cambió con la producción y el procesamiento del metal de osmio cristalino en 2013 y su comercialización como metal de joyería e inversión (Fig. 12) por el recién fundado "Instituto del Osmio" de Baierbrunn [13]. Desde el gran avance en la cristalización, el precio de un gramo de osmio se ha disparado de algo menos de 13 euros a más de 400 euros. En junio de 2019, el precio del osmio en pequeñas cantidades era de 1.280 euros/gramo de osmio (Fig. 13).
4 Análisis químicos del osmio
Además de los métodos de análisis modernos en la investigación y la industria, como la absorción atómica (AAS), el plasma acoplado inducido (ICP) o el análisis por fluorescencia de rayos X (XRF), en algunos casos se siguen utilizando los procesos fotométricos y de precipitación cuantitativa clásicos con reactivos orgánicos [14]. Dado que otros elementos interfieren, se recomienda una separación previa como tetróxido de osmio, OsO4.
Ya en 1918, el químico moscovita Lev Alexandrovich Chugaev (1873-1922) propuso la tiourea para la detección de este elemento. En condiciones de trabajo definidas, se produce un color rojo característico, mientras que el rutenio produce un color azul.
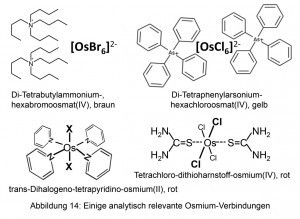
Los cationes alquilo cuaternario y arilamonio, así como el catión tetrafenilarsonio, son adecuados para la precipitación cuantitativa de hexahalogenoosmatos(IV).
El tetrapiridino-dihalogeno-osmio(II) neutro también es muy difícil de disolver. Es accesible, por ejemplo, hirviendo el hexahalogenoosmato(IV) en piridina con glicerol (Fig. 14).
Los análisis isotópicos son algo más complejos: el 186Oses un emisor alfa natural con una vida media de 2,0 x 1015 años. La radiación beta del isótopo del renio 187Reproduce el isótopo estable 187Os. Con altos contenidos geológicos de renio en los yacimientos, la relación 187Os/186Ospuede utilizarse geocronológicamente [15].
5 Tetróxido de Os y compuestos de Os
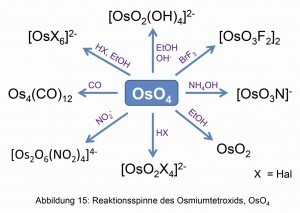
Debido a la práctica oxidabilidad del osmio al tetróxido, OsO4, y al bajo punto de ebullición, la mayoría de los demás compuestos de osmio parten del tetróxido de osmio (Fig. 15).
El óxido de osmio(VIII) se produce a partir del metal osmio oxidando soluciones de osmio con ácido nítrico o peroxodisulfato sódico en ácido sulfúrico. Debido a su volatilidad y toxicidad, se vende fundido en ampollas [16].
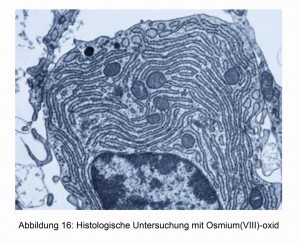
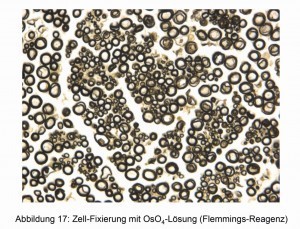
Además de las aplicaciones ya descritas, el OsO4 se utiliza en particular para exámenes histológicos [17]. Los bordes de las células adquieren diferentes colores y, por tanto, pueden reconocerse fácilmente al microscopio óptico. En las figuras 16 y 17 se muestran dos ejemplos.
El compuesto es sólo ligeramente soluble en agua, pero muy soluble en tetracloruro de carbono, CCl4.
Mediante reacciones fotoquímicas, los iones haluro de los hidrocarburos halogenados pueden unirse al osmio como ligando [18].
Con ácidos halogenados, como el ácido clorhídrico, el óxido de osmio(VIII) se convierte rápidamente en hexahalogeno-osmio(IV) según la siguiente ecuación
OsO4 + 10 HCl → H2[OsCl6] + 2 Cl2 + 4 H2O.
Por precipitación a partir de soluciones concentradas de hexacloro-osmate(IV) de potasio, K2OsCl6, con ácido clorhídrico concentrado, se obtienen soluciones sólidas homogéneas en cualquier proporción de mezcla deseada [19]. La evolución de las constantes de red sigue la "regla de Vegard". Esta regla describe la dependencia lineal de las constantes de red de una solución sólida sustitutiva o de una aleación con respecto al porcentaje de componentes [20].
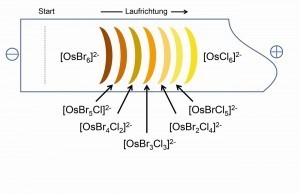
La conversión incompleta de K2[OsCl6] en HBr produce la serie de siete complejos de ligando mixto del tipo K2[OsClxBr6-x], que son visibles por separado en sus colores típicos al pasar al cátodo con ayuda de la electroforesis (Fig. 18) y también son accesibles por preparación. De este modo, se puede acceder a una gran cantidad de complejos de ligandos mixtos con diversos ligandos inorgánicos y orgánicos [21].
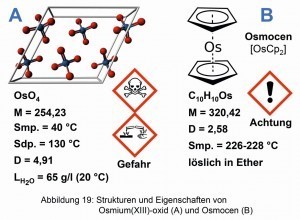
El osmoceno es un interesante compuesto de osmio. Fue sintetizado por primera vez por Ernst Otto Fischer (1918-2008) y Heinrich Grumbert, a partir de OsO4 [22]. Junto con Geoffrey Wilkinson, Fischer recibió el Premio Nobel de Química en 1973 por sus trabajos sobre los "compuestos sandwich" organometálicos [23]. Se dice que las aplicaciones para la descomposición fotocatalítica del agua han tenido bastante éxito con el osmoceno [24]. La figura 19 muestra las estructuras y propiedades del óxido de osmio (IV) y del osmoceno.
A pesar de las preparaciones de osmio, en parte bastante estables desde el punto de vista termodinámico y cinético, sólo se han documentado relativamente pocos compuestos con datos químicos y físicos. Esto también puede deberse a los caros materiales de partida y a las limitadas aplicaciones de este elemento.
Bibliografía
[1] https://de.wikipedia.org/wiki/Osmium
[2] Wolf, I.: Crystalline osmium, the rarest precious metal on earth, Instituto del Osmio, presentación en Invest 2019, https://www.insignitus.com/de/blog/kristallines-osmium-das-seltenste-und-dichteste-edelmetall-der-erde/
[3] Lista de yacimientos de osmio en Mineralienatlas y Mindat
[4] Hasenpusch, W.: Disertación, Universidad de Kiel, 1976
[5] https://www.brandeins.de/magazine/brand-eins-wirtschaftsmagazin/2016/intuition/osmium-os
[6] https://www.chemie-schule.de/KnowHow/Wiedemann-Franzsches_Gesetz
[7] https://www.heraeus.com/en/hch/products_and_solutions_chemicals/chemical_products/pgm_solutions_pc/os_pc/osmium_page_pc.html
[8] https://www.chemicool.com/elements/osmium.html
[9] https://www.azom.com/article.aspx?ArticleID=1842
[10] https://de.wikipedia.org/wiki/Dihydroxylierung
[11] https://www.technology.matthey.com/article/18/3/94-96
[12] Hill, A.F.: Organotransition Metallic Chemistry of Sulfur Dioxide Analogues, Advances in Organometallic Chemistry, 1994.
[13] www.osmium-institute.com; https://www.buy-osmium.com/de/barren/disk/
[14] MERCK, Darmstadt: Organic reagents for trace analysis, Osmium, 1975
[15] Faure, G.: Priciples of Isotope Geology, Wiley, N.Y.. (1977), 2ª ed. (1986) 608 páginas, RÖMPP Osmio
[16] https://de.wikipedia.org/wiki/Osmium(VIII)-óxido
[17] https://www.chemistryworld.com/podcasts/osmium-tetraoxide/7656.article
[18] Hasenpusch, W.; Preetz, W.: Photochemical ligand exchange on hexahalogenoosmates(IV), ZAAC, 432 (1977) 107-114
[19] Müller, H.; Rödl, M.: The solid solution system K2OsCl6, ZAAC, 608 (1992) 145-146
[20] https://de.wikipedia.org/wiki/Vegardsche_Regel
[21] Preetz, W., Blasius, E.: Gemischtligandkomplexe, I. Allgemeine und theoretische Betrachtungen über Bildung von Gemischtligandkomplexen und ionophoretische Trennmöglichkeiten, 332 (1964) 140-148
[22] https://de.wikipedia.org/wiki/Osmocen
[23] https://de.wikipedia.org/wiki/Ernst_Otto_Fischer
[24] Kunkely, H.; Vogler, A.: Water splitting by light with osmocene as photocatalyst, Angew. Chem, 121(2009) 1713-5