Una patente estadounidense de 1945 describe el uso de mezclas de ácidos alcanosulfónicos con 1 a 5 átomos de carbono para la electrodeposición de plomo y níquel en diversos metales, sin dar detalles de la composición exacta de los electrolitos ni de los parámetros de electrólisis [1]. A partir de 1982, varias patentes describieron el uso de electrolitos de ácido alcanosulfónico para el estañado electrolítico del acero en la producción de hojalata como alternativa a los electrolitos de fluoroborato utilizados anteriormente [2-4]. A partir de 2003, un nuevo proceso permitió producir grandes cantidades de ácido metanosulfónico con la pureza necesaria para los procesos galvánicos [5]. Aunque la capacidad de producción anual era de 10.000 toneladas en 2003, se aumentó a 30.000 toneladas en 2012 debido al aumento de la demanda. Para finales de 2021 está previsto un nuevo aumento de la capacidad de producción hasta las 50.000 toneladas anuales [6]. Hace unos meses, BASF también volvió a aumentar su capacidad de ácido metanosulfónico con la puesta en marcha de una nueva planta (Fig. 1)
 Fig. 1: El uso industrial del ácido metanosulfónico en la industria no ha dejado de aumentar desde 2003. Además de en galvanoplastia, se utiliza en la síntesis de biocombustibles y en la limpieza industrial. EnLudwigsburg, BASF ha vuelto a aumentar recientemente su capacidad con una nueva planta de ácido metanosulfónico. Las siguientes secciones ofrecen una visión general del uso de electrolitos de ácido metanosulfónico para la deposición de metales y aleaciones en galvanoplastia. La mayoría de las publicaciones y patentes sobre el uso del ácido metanosulfónico en galvanoplastia se refieren al estañado de bandas de acero para producir hojalata o a la deposición de estaño y aleaciones de estaño sobre cobre para producir superficies soldables. El ácido ya se utiliza en la industria en estos ámbitos. También hay estudios individuales sobre la deposición de oro, plata, cobre, indio y bismuto a partir de electrolitos de ácido metanosulfónico. Además del uso del ácido metanosulfónico en baños galvánicos, el ácido también se utiliza como catalizador en limpiadores industriales y domésticos respetuosos con el medio ambiente y en la industria química.
Fig. 1: El uso industrial del ácido metanosulfónico en la industria no ha dejado de aumentar desde 2003. Además de en galvanoplastia, se utiliza en la síntesis de biocombustibles y en la limpieza industrial. EnLudwigsburg, BASF ha vuelto a aumentar recientemente su capacidad con una nueva planta de ácido metanosulfónico. Las siguientes secciones ofrecen una visión general del uso de electrolitos de ácido metanosulfónico para la deposición de metales y aleaciones en galvanoplastia. La mayoría de las publicaciones y patentes sobre el uso del ácido metanosulfónico en galvanoplastia se refieren al estañado de bandas de acero para producir hojalata o a la deposición de estaño y aleaciones de estaño sobre cobre para producir superficies soldables. El ácido ya se utiliza en la industria en estos ámbitos. También hay estudios individuales sobre la deposición de oro, plata, cobre, indio y bismuto a partir de electrolitos de ácido metanosulfónico. Además del uso del ácido metanosulfónico en baños galvánicos, el ácido también se utiliza como catalizador en limpiadores industriales y domésticos respetuosos con el medio ambiente y en la industria química.
Propiedades del ácido metanosulfónico
El ácido metanosulfónico difiere del ácido sulfúrico en que un grupo OH del ácido sulfúrico se sustituye por un grupo CH3 (Fig. 2). Debido a su estructura similar, muchas propiedades de ambos ácidos también son parecidas [5, 7].
A diferencia del ácido sulfúrico dibásico, el ácido metanosulfónico es un ácido orgánico fuerte monobásico (pKs = -1,9), que se disocia casi por completo en una solución 0,1 molar. Es térmicamente estable hasta una temperatura de 180 °C y química y electroquímicamente estable en el intervalo de potencial de -1,4 V a +2,4 V. Por lo tanto, no se ve afectado por la adición de agentes oxidantes fuertes como el peróxido de hidrógeno ni por la electrólisis en la que se genera oxígeno en ánodos insolubles. Tiene una baja presión de vapor, es incoloro, inodoro y no forma gases tóxicos. En comparación con los electrolitos de ácido sulfúrico o ácido nítrico, sus propiedades de dispersión y recubrimiento son mejores, por lo que se pueden depositar cátodos de cobre lisos y de gran pureza de forma compacta a partir de electrolitos de ácido metanosulfónico sin necesidad de añadir aditivos ni plata [8, 9].
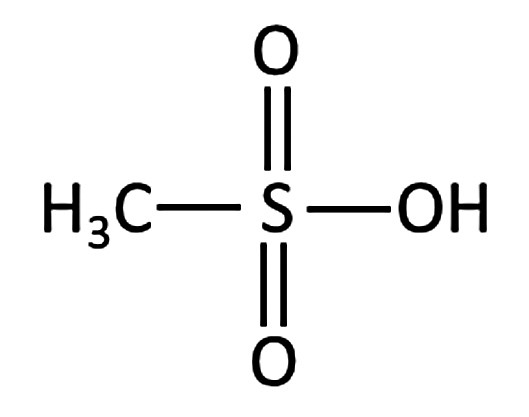 Fig. 2: Fórmula estructural del ácido metanosulfónico
Fig. 2: Fórmula estructural del ácido metanosulfónico
Un requisito previo esencial para la deposición electrolítica de metales es una alta solubilidad de los metales en el electrolito. Como muestra la Tabla 1, muchos sulfonatos metálicos son fácilmente solubles en agua.
En particular, el plomo y la plata, cuyos sulfatos son poco solubles, tienen una solubilidad muy elevada en electrolitos de ácido metanosulfónico. La solubilidad del estaño, zinc, níquel, hierro, cobre, cobalto y cadmio también es mucho mayor en comparación con los electrolitos de ácido sulfúrico. Debido a la alta solubilidad para muchos metales, la muy buena estabilidad química y electroquímica, la buena conductividad eléctrica y la baja toxicidad, los electrolitos de ácido metanosulfónico son adecuados para su uso en galvanoplastia y para la extracción electrolítica y el refinado de metales.
Una desventaja del ácido metanosulfónico es su precio más elevado en comparación con el ácido sulfúrico. Además, el metanosulfonato cálcico es fácilmente soluble, por lo que el metanosulfonato no puede separarse por precipitación con lechada de cal en el tratamiento de aguas residuales. El ácido metanosulfónico es fácilmente biodegradable y se descompone en dióxido de carbono y sulfato. Por tanto, forma parte del ciclo natural del azufre y también se conoce como "ácido verde".
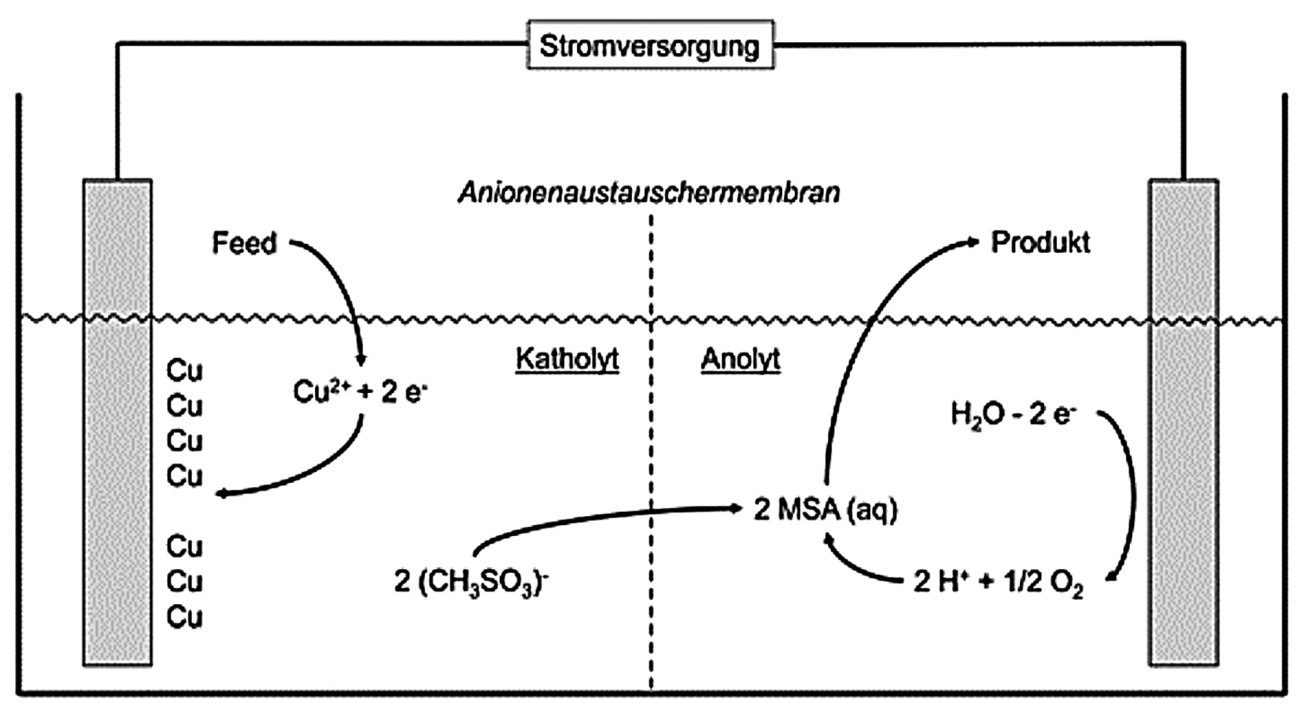 Fig. 3: Recuperación electrolítica del ácido metanosulfónico
Fig. 3: Recuperación electrolítica del ácido metanosulfónico
Debido al precio más elevado del ácido metanosulfónico, la recuperación electrolítica del ácido metanosulfónico en una célula electrolítica, en la que la cámara catódica y la cámara anódica están separadas por una membrana de intercambio aniónico, es una buena opción [7]. La figura 3 muestra un ejemplo de este proceso para el tratamiento de electrolitos que contienen cobre. El electrolito se canaliza hacia la cámara catódica, donde el cobre se deposita catódicamente. El cobre puede venderse o refundirse en nuevos ánodos. Los iones de metano sulfonato entran en la cámara anódica a través de la membrana de intercambio iónico y, de este modo, pueden volver a introducirse en el proceso. Las impurezas contenidas en el electrolito (por ejemplo, productos de descomposición de los aditivos) se acumulan en la cámara catódica y pueden eliminarse a través del sistema de tratamiento de aguas residuales si se superan los valores límite definidos por el proceso después de haber eliminado el cobre en la medida de lo posible.
Separación de estaño y aleaciones de estaño
Deposición de estaño
Las capas de estaño electrodepositado tienen una gran importancia industrial, ya que protegen el metal base de la corrosión y la oxidación por el aire y presentan una buena soldabilidad. Entre sus principales aplicaciones se encuentran el estañado de bandas de acero (hojalata), alambres y placas de circuitos impresos para la industria eléctrica y electrónica. Además del estaño puro, también se utilizan diversas aleaciones de estaño con otros metales como plomo, cobre, zinc, plata, níquel y cobalto.
En principio, el estaño puede depositarse electrolíticamente a partir de electrolitos ácidos, neutros o alcalinos. Los electrolitos de estaño de ácido sulfúrico se utilizan no sólo en galvanoplastia, sino también en la electrólisis de refinado para producir estaño de gran pureza. Sin embargo, debido al riesgo de pasivación del ánodo, el electrolito de ácido sulfúrico no es adecuado para altas densidades de corriente. Otro problema de este electrolito es la oxidación del estaño bivalente a estaño tetravalente y la formación asociada de ácidos de estaño coloidales o gelatinosos, que son difíciles de filtrar.
En el pasado, los electrolitos basados en fluoroborato se utilizaban a menudo para la deposición industrial de estaño y aleaciones de estaño-plomo a altas densidades de corriente. Las ventajas de este electrolito son la buena solubilidad del estaño y el plomo, el buen poder de penetración, su uso incluso a altas densidades de corriente y, por tanto, la obtención de altas velocidades de deposición, altos rendimientos de corriente y la deposición de capas de grano fino. Los electrolitos de fluoroborato tienen una estabilidad química relativamente buena. Sin embargo, se produce una pequeña descomposición con la formación de ácido fluorhídrico:
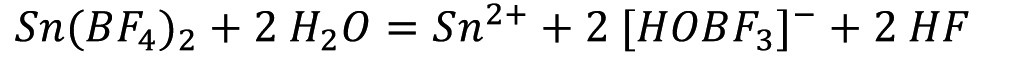
<1>
Como consecuencia, este electrolito es muy corrosivo y existe el riesgo de que se emita fluoruro de hidrógeno tóxico. Otra desventaja es el tratamiento muy complejo de las aguas residuales. En comparación con el ácido tetrafluorobórico, el ácido metanosulfónico es mucho menos corrosivo y tiene propiedades ligeramente reductoras, lo que significa que el riesgo de formación de estaño tetravalente y, por tanto, de formación de lodos es algo menor. También es menos tóxico. El valor LD50 para el ácido tetrafluorobórico es de 495 mg/kg y para el ácido metanosulfónico de 1158 mg/kg. Por lo tanto, los electrolitos de ácido metanosulfónico tienen claras ventajas sobre los electrolitos de ácido tetrafluorobórico o ácido sulfúrico para la electrodeposición de estaño o aleaciones de estaño-plomo. Por este motivo, desde aproximadamente 1985 se han llevado a cabo investigaciones sistemáticas sobre el estañado electrolítico a partir de electrolitos de ácido metanosulfónico, en particular para el estañado de flejes de acero y cobre.
La capacidad de producción mundial anual de chapa de acero estañada (hojalata) supera los 10 millones de toneladas. La hojalata se utiliza principalmente en forma de latas y botes para alimentos/alimentos para animales (aprox. 45%), productos químicos/técnicos (aprox. 21%), bebidas (aprox. 16%) y cierres (aprox. 18%). Las fases del proceso de laminado en frío, desengrasado, recocido y relaminado tienen lugar antes del estañado electrolítico. Tras el estañado electrolítico, la capa de estaño puede fundirse por inducción, pasivarse la superficie para evitar la formación de óxidos de estaño, pintarse o laminarse. Las líneas de estañado de bandas suelen trabajar con densidades de corriente de entre 1000 y 6000 A/m2 y velocidades de banda de hasta 600 m/min, por lo que la banda de acero puede estañarse por uno o dos lados. Dependiendo de los requisitos del cliente, el recubrimiento de estaño es de 1 a 15 g/m2, lo que corresponde a espesores de capa de aprox. 0,1 a 1,5 µm. El revestimiento de estaño sobre hojalata debe cumplir requisitos de calidad muy elevados. Debe cubrir completamente el material base, ya que de lo contrario puede producirse corrosión. También se exigen requisitos especiales a la adherencia de la capa de estaño al material base, ya que el conformado en latas o botes tiene lugar después del estañado. Durante el proceso de conformado, la capa de estaño también sirve como lubricante. En el caso de la hojalata pintada, el comportamiento de humectación y la adherencia de la pintura son de gran importancia y, en el caso de la hojalata sin pintar, el aspecto visual, en particular el brillo, es de gran importancia.
Los aditivos utilizados para el estañado de banda de acero en electrolitos de ácido tetrafluorobórico no funcionan de forma óptima en el electrolito de ácido metanosulfónico. Por lo tanto, fue necesario buscar y desarrollar nuevos sistemas de aditivos altamente eficaces para la deposición de estaño.
Los sistemas de aditivos necesarios para la deposición de estaño suelen consistir en sustancias tensioactivas, refinadores de grano, abrillantadores primarios y secundarios y estabilizadores de oxidación [10]. La literatura de patentes [3, 11-15] describe en particular diversos sistemas de aditivos para el estañado de bandas de acero a altas densidades de corriente, cuya descripción completa queda fuera del alcance de esta publicación. La patente DE3902043 [15], por ejemplo, describe un electrolito con 20 g/L de estaño, 70 a 100 g/L de ácido metanosulfónico y un sistema de aditivos consistente en un éter poliglicólico nonyphenol con 15 moles de óxido de etileno, un producto de condensación aldol con cetonas acílicas y metanal para el estañado brillante a altas densidades de corriente. En su tesis doctoral, Wehner [16] investigó el efecto de diversos tensioactivos polietoxilados no iónicos, como un polímero de óxido de propileno-etileno (Pluronic RPE 310), etoxilatos de naftaleno (Lugalvan), diversos etoxilatos de nonilfenol (Lutensol AP) y éteres de polieoxietileno-larilo, sobre la deposición de estaño y aleaciones de estaño-plata a partir de electrolitos de ácido metanosulfónico.
Aunque el ácido metanosulfónico tiene un débil efecto reductor, la introducción de oxígeno del aire en el electrolito oxida parte del estaño divalente a la fase tetravalente. En los procesos lentos, se forman precipitados de óxidos básicos de estaño, que son difíciles de filtrar y se incorporan parcialmente a la capa de estaño depositada catódicamente. En el estañado de acero en banda, en particular, las elevadas velocidades de banda provocan una mayor entrada de aire en el electrolito. Los principales inhibidores de la oxidación utilizados en los electrolitos de ácido metanosulfónico son el ácido cresol sulfónico, la hidracina, el ácido ascórbico y la hidroquinona y sus derivados.
Debido a sus ventajas sobre los electrolitos de ácido tetrafluorobórico, algunos productores de hojalata utilizan actualmente electrolitos de ácido metanosulfónico en el estañado electrolítico. Además de las ventajas en el proceso tecnológico y en el tratamiento de las aguas residuales, la calidad de la hojalata también ha mejorado gracias a ello.
Por regla general, los ánodos de estaño utilizados en la producción de hojalata electrolítica contienen bajos niveles de plomo. Debido a los potenciales de electrodo estándar casi idénticos para el estaño y el plomo (véase el capítulo siguiente), el plomo entra en solución anódicamente con el estaño, se acumula en el electrolito y se deposita catódicamente con el estaño. La concentración de plomo en la capa de estaño no debe superar los 100 µg/g, especialmente cuando la hojalata se utiliza para envasar alimentos. Por esta razón, se añade hasta 5 g/L de sulfato al electrolito de ácido metanosulfónico para separar el plomo como PbSO4 poco soluble. Martyak y Seefeldt [17] determinaron que el sulfato sólo tiene una influencia menor en la calidad de la capa de estaño.
Además de la deposición de estaño sobre acero, también se realizaron investigaciones sobre la deposición sobre cobre. Según Rosenstein [18], la composición óptima del electrolito para la deposición de estaño sobre cobre es de 200 a 250 g/L de ácido metanosulfónico, 35 a 55 g/L de estaño y una temperatura del electrolito de 21 a 54 °C.
Además de en la galvanoplastia, los electrolitos de ácido metanosulfónico también se utilizan hoy en día industrialmente en la electrólisis de refinado de estaño.
|
Ión metálico |
Metanosulfonato (g/L) |
Sulfato (g/L) |
|
Ag+ |
713 |
9 |
|
Ca2+ |
656 |
3 |
|
Cd2+ |
975 |
646 |
|
Co2+ |
630 |
335 |
|
Cu2+ |
546 |
215 |
|
Fe2+ |
690 |
266 |
|
Fe3+ |
502 |
440 |
|
Hg2+ |
707 |
0 |
|
Mg2+ |
378 |
317 |
|
Mn2+ |
849 |
532 |
|
Ni2+ |
665 |
378 |
|
Pb2+ |
1075 |
0 |
|
Sn2+ |
1066 |
305 |
|
Zn2+ |
792 |
536 |
Deposición de aleaciones estaño-plomo
Los revestimientos de aleaciones estaño-plomo se utilizan ampliamente como materiales de soldadura debido a su bajo punto de fusión, sus buenas propiedades mecánicas y su fiabilidad técnica. El estaño y el plomo son miscibles en toda la gama de concentraciones y no forman compuestos intermetálicos. La aleación eutéctica con un 63 % de Sn y un 37 % de Pb y un punto de fusión de 183 °C resulta especialmente interesante como material de soldadura.
Para la deposición electrolítica de aleaciones, es una gran ventaja que el Sn y el plomo tengan casi los mismos potenciales de electrodo estándar:
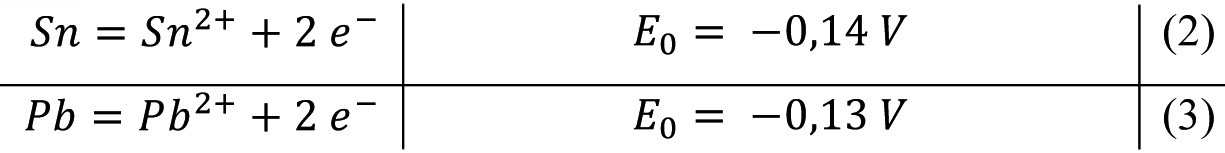
Como las curvas de densidad de corriente-potencial para la deposición catódica de estaño y plomo son casi idénticas en electrolitos sin aditivos, la deposición de aleaciones de estaño-plomo en toda la gama de concentraciones es relativamente sencilla. La composición deseada de la aleación se establece mediante la relación de concentración de estaño y plomo en el electrolito [14, 17]. Según Rosenstein [17], la composición óptima del electrolito para la deposición de una aleación con un 60 % de Sn y un 40 % de Pb es de 16 g/L de Sn y 10 g/L de Pb, y para una aleación con un 90 % de Sn y un 10 % de Pb, de 21 g/L de Sn y 3 g/L de Pb.
Según diversas patentes, los mismos aditivos pueden utilizarse para la electrodeposición de estaño, aleaciones de estaño-plomo y plomo [2-4, 13, 19, 20]. La composición química de la capa depositada está controlada esencialmente por la composición química del electrolito, mientras que la densidad de corriente y la temperatura del electrolito no suelen modificarse.
Para producir uniones soldadas uniformes con soldaduras de estaño-plomo, se requieren temperaturas entre 240 y 250 °C, que es significativamente superior al punto de fusión de la aleación eutéctica. Estas temperaturas relativamente altas pueden provocar problemas a la hora de producir uniones soldadas entre células solares. Para este campo de aplicación, en [21] se proponen aleaciones ternarias de estaño-plomo-bismuto con 2,5 a 5 % de Bi, que tienen un punto de fusión significativamente más bajo en comparación con las aleaciones binarias. La deposición electrolítica de esta aleación se llevó a cabo a partir de electrolitos de ácido metanosulfónico. La composición química de la capa se controló mediante concentraciones de Sn, Pb y Bi en el electrolito. Como aditivos se añadieron al electrolito una mezcla de etoxilato de octilfenol, tamol NN8906, fenilurea, metilhidroquinona y ácido fenolsulfónico.
Como el plomo es tóxico, la Unión Europea ha prohibido su uso en componentes electrónicos en virtud de las directivas RAEE (Residuos de Aparatos Eléctricos y Electrónicos) y RUSP (Restricción de Determinadas Sustancias Peligrosas). Además del estaño puro, en el que pueden surgir problemas debido a la formación de whiskers, las aleaciones binarias y ternarias de estaño con plata, cobre y bismuto también se describen como superficies soldables sin plomo.
Deposición de aleaciones de estaño y bismuto
Una alternativa al plomo en las aleaciones de soldadura es el bismuto, que es completamente miscible con el estaño en toda la gama de concentraciones. La aleación eutéctica con un 43 % de Sn y un 57 % de Bi funde a 138 °C. El punto de fusión de esta aleación es, por tanto, sensiblemente inferior al del estaño (232 °C) y al de la aleación eutéctica estaño-plomo (183 °C). La adición de bismuto es una medida eficaz para minimizar la formación de whiskers.
El potencial de electrodo estándar para la reacción

<4>
es significativamente más electropositivo que el del estaño (reacción <2>), de modo que el bismuto se deposita preferentemente a partir de soluciones libres de complejos en comparación con el estaño.
Goh y colaboradores [22] llevaron a cabo investigaciones electroquímicas fundamentales sobre la deposición de aleaciones binarias de estaño-bismuto sobre cobre como metal base a partir de electrolitos de ácido metanosulfónico. El estaño se añadió al electrolito como sulfato de estaño, de modo que el electrolito también contenía sulfato. Las investigaciones mostraron que sólo se deposita bismuto a partir de electrolitos sin aditivos. Añadiendo hidroquinona y gelatina, fue posible la deposición conjunta de estaño y bismuto. La composición química de la aleación depositada depende de la densidad de corriente, disminuyendo la concentración de bismuto en la capa al aumentar la densidad de corriente. Las densidades de corriente más elevadas también dieron lugar a la deposición de cristales dendríticos de bismuto.
Deposición de aleaciones estaño-plata
Las aleaciones de estaño-plata se describen en la bibliografía como revestimientos soldables sin plomo. La aleación eutéctica con 96,5 % de Sn y 3,5 % de Ag tiene un punto de fusión de 221 °C. La aleación presenta una buena resistencia y un buen comportamiento a la fluencia. Sin embargo, debe respetarse estrictamente la proporción de aleación, ya que incluso contenidos de plata ligeramente superiores provocan un aumento significativo de la temperatura de fusión. El envejecimiento puede provocar la formación de una capa más gruesa de óxido o sulfuro en la superficie recubierta, lo que tiene un efecto negativo sobre la soldabilidad.
El potencial de electrodo estándar de la reacción

<5>
es significativamente más electropositivo que el del estaño, por lo que la adición de un agente complejante fuerte es absolutamente necesaria para la plata. La adición de tiourea en concentraciones entre 20 y 200 g/L como agente complejante se describe habitualmente en la bibliografía [16, 23-25]. Wehner [16] investigó la deposición de aleaciones de estaño-plata sobre cobre con un electrolito compuesto por 25 g/L de estaño, 1 g/L de plata, 90 g/L de ácido metanosulfónico y diversas concentraciones de tiourea a densidades de corriente de 50 a 1000 A/m2 en una célula Hull. Como aditivo adicional, el electrolito contenía 0,002 mol/L de polioxietilen lauril éter. Para que se formara un complejo plata-tiourea estable, se requería un exceso de tiourea respecto a la plata de al menos 20 veces. El contenido medio de plata en la capa dependía de la concentración de tiourea y de la densidad de corriente y disminuía con el aumento de la densidad de corriente desde aproximadamente el 50 % al 10-14 % de Ag. El contenido de plata en la capa seguía siendo, por tanto, significativamente superior a la concentración de plata en el eutéctico. Los análisis puntuales realizados con EDX también revelaron una distribución muy poco homogénea de la plata en la capa. Por tanto, las aleaciones de estaño y plata depositadas en estas condiciones no cumplen las condiciones para su uso técnico como aleación de soldadura.
Una patente estadounidense [26] describe la deposición de aleaciones de estaño-plata a partir de electrolitos de ácido metanosulfónico con la adición de compuestos aromáticos de tiol o compuestos aromáticos de sulfuro. La concentración de estaño en el electrolito era de 25 g/L, la concentración de plata de 1 ó 2 g/L y la concentración de ácido metanosulfónico de 350 ó 1150 g/L. En los ejemplos de realización, se utilizaron como aditivos 20 g/L de 2-aminotiofenol y 5 g/L de disulfuro de 2,2-dipiridilo. Las deposiciones se llevaron a cabo en una célula Hull sobre acero inoxidable pulido. La concentración de plata en las capas depositadas se situó entre el 3,0 y el 3,6% en condiciones óptimas y, por tanto, en el rango del eutéctico. No hay información en la patente sobre la estructura y homogeneidad química de las capas producidas. Otra ventaja mencionada en la patente es que el electrolito permaneció estable durante al menos 60 días sin formación de precipitados.
Deposición de otros metales
En estudios sobre la deposición de cobre a partir de electrolitos de ácido metanosulfónico, Felicita et al [27] demostraron que las capas producidas tenían tamaños de grano significativamente más pequeños y menos inclusiones de oxígeno en comparación con la deposición a partir de electrolitos de ácido sulfúrico. Una patente [28] describe la electrodeposición de cobre a partir de electrolitos de ácido alcanosulfónico. Otra patente [29] también describe la electrodeposición de cobre en un proceso de dos etapas que consiste en el pretratamiento y la deposición electrolítica. Según [30], el electrolito de ácido metanosulfónico también es adecuado para depositar capas finas de cobre a altas densidades de corriente de hasta 5000 A/m2. Las investigaciones sobre el uso de electrolitos de ácido metanosulfónico en la electrólisis de refino de cobre han demostrado que, a diferencia de la electrólisis convencional a partir de electrolitos de ácido sulfúrico, es posible la deposición de cátodos de cobre lisos y de gran pureza a partir de electrolitos sin aditivos [8].
En galvanoplastia, los electrolitos de cianuro se utilizan a menudo para la deposición de oro y plata. Debido a la alta toxicidad de estos electrolitos y al complejo tratamiento de las aguas residuales, es deseable su sustitución por otros electrolitos. En su tesis, Ehnert [31] investigó la producción de metanosulfonato de ditiourea de oro(I) y su uso para la deposición electrolítica y sin electrólisis de capas finas de oro. El electrolito se produjo por disolución anódica del oro en un electrolito de ácido metanosulfónico y tiourea en una célula electrolítica en la que el compartimento anódico estaba separado del compartimento catódico por un diafragma. Durante la deposición catódica de oro sobre cobre, la capa se ennegrecía incluso a densidades de corriente relativamente bajas. Además, la capa se adhería mal al sustrato. Por el contrario, se consiguió una muy buena adherencia de los depósitos de oro soldables con la deposición electrolítica de oro mediante el proceso ENIG.
Una patente [32] describe el efecto de varios aditivos en la deposición de plata a partir de electrolitos sin cianuro. En la mayoría de los ejemplos, se utiliza un electrolito básico con 10 a 30 g/L de plata y 80 g/L de ácido metanosulfónico. Las densidades de corriente se situaron entre 100 y 250 A/m2.
En su tesis, Dressler [9] investigó el mecanismo de deposición de plata a partir de electrolitos de ácido metanosulfónico para su uso en la electrólisis de refinado de plata. Mientras que en la deposición "clásica" a partir de electrolitos de ácido nítrico débil (electrólisis de Möbius) sólo se depositan cristalitos poco adheridos en el cátodo, la deposición compacta de plata es posible a partir del electrolito de ácido metanosulfónico.
Otras patentes describen la electrodeposición de bismuto [33] y de indio y aleaciones de indio [34] a partir de electrolitos de ácido metanosulfónico con diversos aditivos.
Resumen
El ácido metanosulfónico es un ácido muy interesante para la galvanoplastia debido a su alta solubilidad para muchos metales, su gran estabilidad química y electroquímica y su baja toxicidad. La literatura técnica y de patentes describe principalmente investigaciones sobre la deposición de estaño, aleaciones de estaño, cobre y plata. Hoy en día, el ácido se utiliza técnicamente en el estañado de bandas de acero para la producción de hojalata, en la electrólisis de refinado de estaño y para la producción de aleaciones de estaño-plomo de gran pureza. En los últimos años, varios institutos de investigación han colaborado con la industria para investigar otros campos de aplicación en la galvanoplastia y para el refinado y la extracción electroquímica de diversos metales.
LOS AUTORES
Dr. Hartmut Bombach
Instituto de Metalurgia no Férrea y Materiales de Alta Pureza TU Bergakademie Freiberg
Profesor universitario Dr. Alexandros Charitos
Director del Instituto de Metalurgia no Férrea y Materiales de Alta Pureza TU Bergakademie Freiberg
Bibliografía
[1] Patente estadounidense 2525942 (1945)
[2] Patente EP 0172267 (1984)
[3] Patente US 4582576 (1985)
[4] Patente US 4662399 (1986)
[5] Lutropur el ácido amistoso Publicación de la empresa BASF (2011)
[6] Comunicado de prensa de BASF P115/20 del 20.01.2020
[7] Gernon, M.; Wu, M.; Buszta, T.; Janney, P.: Green chemistry (1999) 6, 127-139
[8] Bombach H.; Stelter M.; Baumbach J.; Thiere A.: A new electrolyte for copper electrorefining, Actas EMC, 1 (2015), 209-218
[9] Dressler, A.: Investigaciones sobre la deposición de plata a partir de ácido metanosulfónico, Disertación TU Bergakademie Freiberg, (2020)
[10] Jordan, M.: The galvanic deposition of tin and tin alloys, Leuze Verlag, (1993)
[11] Patente US 4662999 (1987)
[12] Patente DE 69606062 (1998)
[13] Patente estadounidense 5296128 (1993)
[14] Patente US 6342148 (2002)
[15] Patente DE 3902043 (1990)
[16] Wehner, S.: Non-ionic polyethoxylated surfactants methanesulfonic acid tin and tin-silver electrolytes, disertación TU Dresden, (2005)
[17] Martyak, N.; Seefeldt, R.: Galvanotechnik (2004), 2372-2385
[18] Rosenstein, C.: Metal Finishing, enero de 1990, 17-21
[19] Patente estadounidense 4701244 (1985)
[20] Patente US 4885064 (1989)
[21] Patente EP 3290147 (2018)
[22] Goh, Y.; Haseeb, A.; Sabri, M.: Electrochimica Acta 90 (2013), 265-273
[23] Joseph, S.; Phatak, G.: Material Science and Engineering B 168 (2010), 219-223
[24] Patente estadounidense 6099713 (2000)
[25] Patente estadounidense 2003/0024822 (2003)
[26] Patente estadounidense 5911866 (1999)
[27] Felicita, S.; Nisha, F. y otros: International Journal of ChemTech Research (2011) 3, 1318-1325
[28] Patente estadounidense 6605204 (2000)
[29] Patente estadounidense 7575666 (2006)
[30] Patente estadounidense 6676823 (2002)
[31] Ehnert, R.: Síntesis de metanosulfonato de oro(1)-ditiourea y sus posibles aplicaciones, tesis TU Chemnitz, (2020)
[32] Patente estadounidense 2007/0284258
[33] Patente de la UE 3150743 (2017)
[34] Patente de la UE 3199666A1 (2018)





