3.2 Rheologische Eigenschaften
Mit einem Rotationsviskosimeter (MCR301, Anton Parr) wurde der Einfluss von Art und Konzentration des Gel-Bildners und der Elektrolytbestandteile auf die rheologischen Eigenschaften der Gele untersucht. Dafür wurden an einem kreisrunden Gel (Ø 20 mm, Dicke 3 mm) Oszillationsversuche im so genannten Platte-Platte-Aufbau durchgeführt, bei denen mit einer Kreisfrequenz von 10 rad/s (1,6 Hz) die Deformation von 0,01 bis 100 % schrittweise erhöht wurde. Variiert wurden die Parameter Gel-Konzentration und NaCl-Gehalt sowie Variationen von Agar und Agarose in Abhängigkeit vom pH-Wert des Elektrolyten (alkalisch, neutral, sauer).
Als Ergebnis der Messungen erhält man die Verläufe des Speichermoduls G' für das elastische Verhalten und des Verlustmoduls G'' für das viskose Verhalten über der Deformation, aus denen weitere Kennwerte bestimmt bzw. berechnet werden können. So z. B. die Größe der Module im Plateaubereich, die zulässige elastische Deformation und den so genannten Crossover-Punkt (Fließspannung bei G' = G''), bei dem sich der Verlauf beider Module schneidet und das Gel zerstört wird. Der Quotient aus G'' und G' wird als Verlustfaktor bezeichnet und ist kennzeichnend für das viskos-elastische Verhalten, welches durch Veränderung der linearen Verläufe ab einer bestimmten Dehnung endet (linear-viskos-elastischer Bereich, LVE). Bei den untersuchten Gelen liegt der Verlustfaktor zwischen 0,07 und 0,025, was für ein überwiegend elastisches Verhalten spricht (> 100 = ideal viskos, < 0,01 = ideal elastisch). Zwei typische Kurvenverläufe für 2 und 4 % Agar (jeweils 0,1 M NaCl) sind in Abbildung 1 dargestellt.
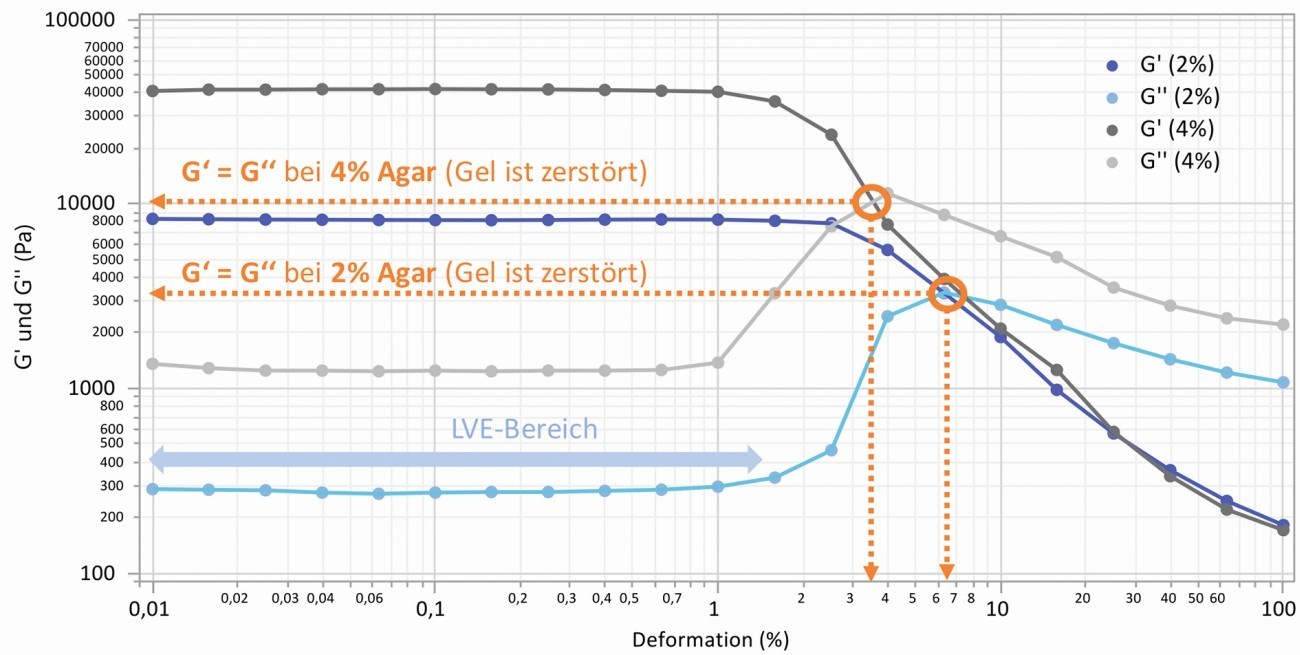 Abb. 1: Verlauf von Speicher- und Verlustmodul über der Deformation am Beispiel von Gel-Proben mit 2 und 4 % Agar (0,1 M NaCl), Kennzeichnung des Crossover-Punktes (Fließspannung)
Abb. 1: Verlauf von Speicher- und Verlustmodul über der Deformation am Beispiel von Gel-Proben mit 2 und 4 % Agar (0,1 M NaCl), Kennzeichnung des Crossover-Punktes (Fließspannung)
Die statistische Auswertung orthogonaler geplanter Versuche ergaben die in Abbildung 2 dargestellten Zusammenhänge, hier exemplarisch für die Fließspannung der Gele. Bei den Variationen der Gel-Konzentration des Agars mit dem Gehalt an NaCl zeigte sich eine starke Abhängigkeit der Fließspannung von der Agar-Konzentration, jedoch keine signifikante Abhängigkeit vom NaCl-Gehalt. Bei der Variation von Agar und Agarose in Abhängigkeit vom pH-Wert kann man erkennen, dass die Agarose aufgrund des höheren Anteils an Gel-Bildner höhere Fließspannungen zulässt als das Agar. Sowohl saurer (0,01 M H2SO4) als auch alkalischer Elektrolyt (0,1 M NaOH) schwächen das Netzwerk und man misst geringere Fließspannungen gegenüber einem neutralen Gel.
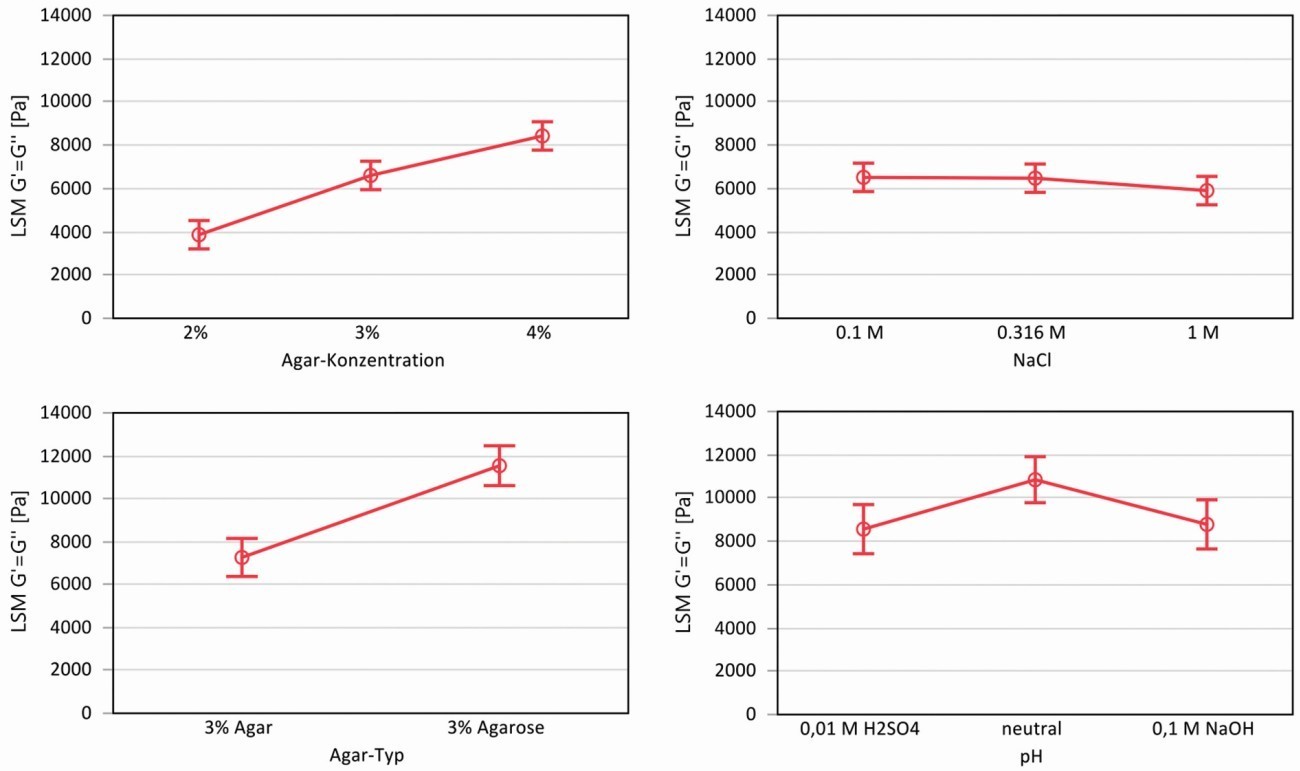 Abb. 2: Statistische Auswertung der rheologischen Versuche nach der Methode der gewöhnlichen kleinsten Quadrate (LSM = Least Squares Mean) für die Fließspannung (Schnittpunkt G‘ und G‘‘), oben: Einfluss von Agar-Konzentration und NaCl, unten: Einfluss von Agar-Typ und pH-Wert
Abb. 2: Statistische Auswertung der rheologischen Versuche nach der Methode der gewöhnlichen kleinsten Quadrate (LSM = Least Squares Mean) für die Fließspannung (Schnittpunkt G‘ und G‘‘), oben: Einfluss von Agar-Konzentration und NaCl, unten: Einfluss von Agar-Typ und pH-Wert
3.3 Elektrolytfilm an der Oberfläche
Um Gele als Elektrolyte für Korrosionsversuche zu verwenden, muss eine ionenleitende Phase an deren Oberfläche vorliegen. Durch den so genannten Synärese-Effekt ist dies bei Agarose-basierenden Gelen der Fall. Die feste Polymerphase durchdringt den wässrigen Elektrolyten und führt physikalisch bedingt zum Austreten eines bestimmten Teils der Flüssigkeit an die Oberfläche und diese bildet dort einen dünnen Elektrolytfilm. Um das Angebot an Elektrolyt an der Oberfläche der Gele zu bestimmen, wurde eine Methodik zur Extraktion des Elektrolytfilms von der Oberfläche entwickelt, die relativ einfach und funktionabel ist. Dazu werden zunächst kreisrunde Gele mit einem Durchmesser von 15 mm aus einer abgegossenen Gel-Platte mit einer Dicke von 6 mm ausgestochen. Diese werden in einen passenden Kunststoffbehälter gelegt und mit einer Präzisionswaage gewogen. Danach wird der Behälter mit dem Gel in eine Vorrichtung gegeben, in der ein Filterpapier der Marke Whatman Grade 1 (11 µm Porengröße) für 3 Sekunden mit 45 cN angedrückt wird (entspricht im Bezug zur Fläche einem Anpressdruck von ca. 0,255 N/cm2). Diese Anpressdruck liegt unterhalb der Fließspannung der Gele, die durch rheologische Messungen bestimmt wurde und ist ausreichend, um den Elektrolytfilm an der Oberfläche vom Filterpapier aufzunehmen, ohne dabei das Gel zu schädigen. Danach wird das Gel im Behälter erneut gewogen. Die Massedifferenz ist proportional dem Volumen des abgezogenen Elektro- lytfilms und kann unter Berücksichtigung der Geometrie und Elektrolytdichte auf ein Äquivalent der Elektrolytfilmdicke umgerechnet werden.
Eine Vielzahl unterschiedlicher Gele, mit Variationen der Agar-Konzentration und der Elektrolytbestandteile, wurden auf diese Weise untersucht. Außerdem wurde auch nach der Seite unterschieden, an der die Gele entweder an Luft (Oberseite) oder an einem Festkörper erstarrten (Unterseite, poliertes Acrylglas). Die Faktoren mit dem größten Einfluss waren die Gel-Konzentration und die Erstarrungsseite bzw. die Oberfläche, die dabei entsteht. Anhand der Abhängigkeit der Elektrolytfilmdicke von der Konzentration des Gel-Bildners ist auch hier ein starker Zusammenhang mit dem Gel-Netzwerk und der Porengröße wahrscheinlich. Abbildung 3 zeigt die Äquivalente für die Elektrolytfilmdicke in Abhängigkeit von der Agar-Konzentration und der Seite an der gemessen wurde in einem Diagramm.
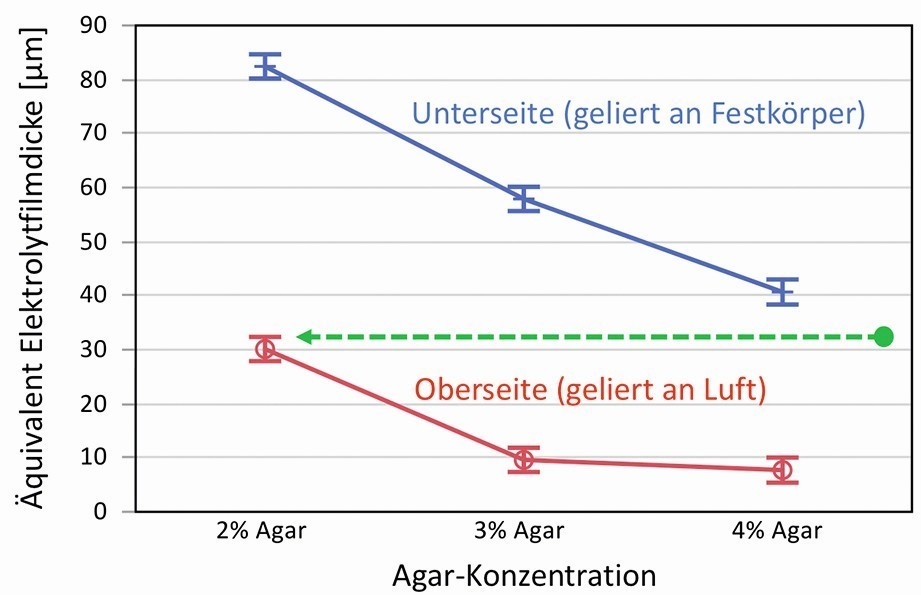 Abb. 3: Ermittelte Äquivalente für Elektrolytfilmdicken von Agar-Gelen in Abhängigkeit von der Agar-Konzentration und der Erstarrung an Luft oder Festkörper, die Bedeutung des Pfeils ist im Text erklärt
Abb. 3: Ermittelte Äquivalente für Elektrolytfilmdicken von Agar-Gelen in Abhängigkeit von der Agar-Konzentration und der Erstarrung an Luft oder Festkörper, die Bedeutung des Pfeils ist im Text erklärt
Eine mögliche Erklärung, warum Ober- und Unterseite derart verschieden voneinander sind, lässt sich zunächst aus der Rauheit der Oberflächen ableiten. Die Gele wurden im flüssigen Zustand auf poliertes Acrylglas gegossen und erstarrten dort. Sie nehmen damit an der Unterseite das glatte Oberflächenprofil weitestgehend an. An der Oberseite dagegen können sie geringfügig abtrocknen und schrumpfen, da diesen Vorgängen durch die Luft so gut wie kein Widerstand entgegengesetzt ist. Dadurch wird die Oberfläche etwas rauer und welliger, wodurch vom Elektrolytfilm möglicherweise ein geringerer Anteil extrahiert wird.
Ein ebenso plausibler, wenn auch nicht sofort erkennbarer Grund für dieses Verhalten liegt in der inneren Gelstruktur kurz unterhalb der Oberfläche. Durch das Abtrocknen bei der Erstarrung können sich die Polymerfasern aufkonzentrieren und zu einer Zone mit dichterem Gel-Netzwerk führen. Dies wurde 2007 bereits von Labille et al. beobachtet [25]. Mittels Diffusionsversuchen wurde nachgewiesen, dass eine ca. 120 µm dicke Zone am Rand des Gels existiert, die ein deutlich dichteres Netzwerk aufweist. So hat nach Aussagen der Autoren ein Agarose-Gel mit nominal 1,5 % Polymeranteil am Rand ein Diffusionsverhalten, dass einem Gel mit 5 % Agarose entspricht und damit ein dichteres Netzwerk. Diese Erkenntnis kann man auf den Zusammenhang in Abbildung 3 übertragen (grüner Pfeil). Wenn man z. B. annimmt, dass ein Gel mit 2 % Agar an der Oberseite eigentlich einem Gel mit ca. 4,5 % Agar entspricht, passen die ermittelten Verläufe sehr gut zusammen. Es zeigt sich also, dass mit steigender Agarose-Konzentration das Äquivalent für die Elektrolytfilmdicke immer weiter abnimmt, d.h. der Austritt an Flüssigkeit an der Oberfläche geringer wird. Außerdem ist zu beachten, dass die an Luft erstarrte Seite eine Zone mit einem dichteren Gel-Netzwerk besitzt und dadurch etwas trockener ist.
Der Einfluss verschiedener Ionen auf die Elektrolytfilmdicke ist dagegen deutlich geringer und statistisch teilweise nicht relevant. Gegenüber destilliertem Wasser als Elektrolytbasis zeigen saure und alkalische Elektrolyte etwas höhere Äquivalente für die Elektrolytfilmdicke. Wie bereits bei den rheologischen Untersuchungen zeigt sich hier der Zusammenhang zum Gelnetzwerk bzw. zur Porengröße. Das Gelnetzwerk kann durch bestimmte Ionen im Elektrolyten geringfügig geschwächt werden und damit steigt der synäresebedingte Austritt von Elektrolyt aus dem Gel.
3.4 Stofftransport von Ionen und Partikeln im Gel
Die rheologischen Eigenschaften und die Ausbildung des Elektrolytfilms zeigen einen deutlichen Zusammenhang zum Gel-Netzwerk auf, das bei ansteigender Gel-Konzentration dichter wird, wodurch sich die Zwischenräume (Poren) verkleinern. Bei der Gel-Elektrophorese nutzt man die unterschiedliche Porengröße gezielt aus, um Nuk- leinsäuren zu identifizieren und aufzutrennen (Molekular- Sieb). Langkettige Verbindungen, aber auch Ionen und Partikel werden durch das Gel-Netzwerk in Abhängigkeit ihrer Größe in ihrer Beweglichkeit behindert. Die Frage ist, in welchem Maße dies bei korrosionsrelevanten Spezies geschieht und welche Konsequenzen dies nach sich ziehen kann.
Für diese Überlegungen muss man sich zunächst die Größe der korrosionsrelevanten Ionenspezies vor Augen führen. Betrachtet man Hydronium- und Hydroxid-Ionen sowie die Ionen von dissoziierten Salzen, sind diese immer von einer Hydrat-Hülle umgeben, die ihre Bewegung im Medium zusätzlich abbremst. Diese hydratisierten Ionen haben Radien im Bereich von 0,2 bis 0,5 nm. Durch Reaktionen von Metallkationen aus Korrosionsprozessen mit Anionen im wässrigen Elektrolyten oder auch gelöstem Sauerstoff entstehen weitere Verbindungen im Medium (Korrosionsprodukte), die an der Metalloberfläche adsorbieren oder auch weiter frei beweglich im Medium vorliegen können. Die Größenordnung kann dabei in den ein- bis zweistelligen Nanometerbereich ansteigen und sie beginnen optisch sichtbar zu werden. Ebenfalls zu betrachten sind noch höher-komplexe Verbindungen und Koagulationen von Teilchen. Für so genannte elektrografische Anwendungen sind gezielte Farb-Indikationen von Ionen-Spezies von Interesse, wie z. B. bei der Reaktion von Kaliumhexacyanoferrat mit Eisenionen zu Berliner Blau. Das allseits bekannte Farbpigment besteht zwar aus einzelnen Partikeln im zweistelligen Nanometerbereich. Es hat aber die Tendenz, geordnete Überstrukturen mit einer Ausdehnung von mehreren hundert Nanometern zu bilden [26].
Von Ogston et al. wurde bereits in den 1970er Jahren ein einfaches Modell vorgestellt, um die Wechselwirkung von sphärischen Teilchen und Makromolekülen mit der der Mikrostruktur von Gelen mit zufällig orientierten steifen Polymerfasern abzuschätzen [27]. In dem nach ihm benannten Ogston-Mechanismus geht der Faser-Volumen- Anteil und die Größe der Teilchen im Verhältnis zur Porengröße ein. Angewandt auf Gel-Elektrolyte kann man den Verlust an Diffusionsvermögen in Relation zur Porengröße und zur Teilchengröße berechnen. Ein formaler mathematischer Zusammenhang zwischen der Agarose-Konzentration und Porengröße ließ sich in der Literatur jedoch nicht finden, da die Abhängigkeit zur verwendeten Messmethode sehr groß ist. Ein Blick in das Gebiet der Agarose-Gel-Elektrophorese kann aber weiterhelfen. Denn die zahlreichen Anbieter von Produkten geben Empfehlungen, mit welcher Agarose-Konzentration das Auftrennen einer bestimmten Anzahl von Basenpaaren optimal möglich ist. So wird z. B. in einem WHO-Protokoll zur Durchführung der Agarose-Gel-Elektrophorese für das Auftrennen von linearer DNA eine Gelkonzentration von 2,5 % für 50 bis 1000 Basenpaare und 1,5 % für 200 bis 4000 Basenpaare vorgeschlagen [28]. Setzt man den Basenpaar-Abstand der DNA mit 0,34 nm an, lässt sich daraus mittels Regression eine Separationslänge in Abhängigkeit von der Agarose-Konzentration ableiten, wie in Abbildung 4 dargestellt. Die ermittelten Werte für die mittlere Separationslänge liegen im Bereich der Porengröße der Agarose-Gele. Der so gefundene formale Zusammenhang zwischen Separationslänge bzw. Porengröße und Agarose-konzentration wurde für die weiteren Berechnungen verwendet.
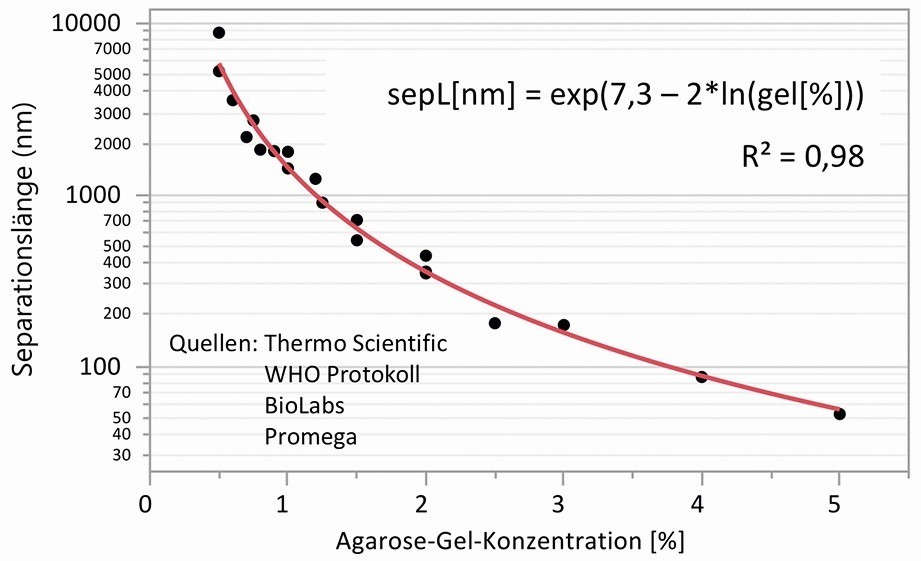 Abb. 4: Separationslänge als Äquivalent für die Porengröße in Abhängigkeit der Agarose-Gel-Konzentration, Daten aus Angaben und Empfehlungen zur Agarose-Gel-Elektrophorese
Abb. 4: Separationslänge als Äquivalent für die Porengröße in Abhängigkeit der Agarose-Gel-Konzentration, Daten aus Angaben und Empfehlungen zur Agarose-Gel-Elektrophorese
Mit Hilfe der Formel in Abbildung 4 lässt sich nun die Diffusionshemmung bzw. Immobilisierung nach dem Ogston-Mechanismus für verschiedene Agarosekonzentrationen und verschieden große sphärischen Teilchen berechnen und visualisieren. In Abbildung 5 ist die Diffusionshemmung über der Porengröße dargestellt, jeweils mit Verläufen für verschiedene Radien von hydratisierten Ionen und sphärischen Teilchen in der Größenordnung von Korrosionsprodukten (5 bis 20 nm) und dem Farbkomplex „Berliner Blau“ als Beispiel im Bereich von 50 bis 400 nm. Gekennzeichnet ist im Diagramm außerdem der Porengrößen-Bereich, in dem sich verschieden konzentrierte Agarose-Gele befinden und ein Bereich für die Porengröße von Filterpapieren, welches ebenfalls häufig als Elektrolytträger für Nachweisreaktionen von Ionen benutzt wird.
![Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4 Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4](/images/stories/Abo-2021-12/gt-2021-12-0078.jpg) Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4
Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4
Die Diffusionshemmung von hydratisierten Ionen bis 1 nm Radius liegt für Porengrößen bis ca. 50 nm unter 1 % und ist damit als Einflussfaktor bei Agar-Gelen bis ca. 5 % zu vernachlässigen. Der Verlust an Beweglichkeit nimmt für Teilchen mit Radien im zweistelligen nm-Bereich (Korrosionsprodukte) zu und liegt bei den Agar-Gelen zwischen 1 und 10 %. Damit ist bereits ein gewisser Grad an Immobilisierung vorhanden, der sich auf Korrosionsreaktionen auswirken kann. Eine längere Verweilzeit von Korrosionsprodukten im dünnen Elektrolytfilm zwischen Metall und Gel kann die Bildung von Deckschichten oder Passivierungsvorgänge verändern. Noch stärker wird die Beweglichkeit von Teilchen mit Radien > 50 nm eingeschränkt, bis hin zur fast kompletten Unbeweglichkeit bei Teilchen mit Radien > 400 nm in Agar-Gelen um 3 %. Für Indikatorreaktionen, wie z. B. der Nachweis von Eisenionen durch Bildung von Berliner Blau, bedeutet dies, das nach der Reaktion das Farbpigment am Ort der Reaktion festgehalten wird, wobei es sich bei der Verwendung von Filterpapieren mit Porengrößen von 15 bis 1,5 µm noch relativ ungehindert bewegen kann.
– wird fortgesetzt –
Literatur
[1] Laque, F.L.; May, T.P.; Uhlig, H.H.: Corrosion in Action, International Nickel Company Canada, 1955
[2] Isaacs, H.S.; Adzic, G.; Jeffcoate, C.S.: Visualizing Corrosion, Corrosion 56 (2000) 10, 971–978, https://doi.org/10.5006/1.3294386
[3] DIN EN ISO 10309:2016-08: Metallische Überzüge – Prüfverfahren zur Bestimmung der Porosität – Ferroxylprüfung (ISO 10309:1994), Deutsche Fassung EN ISO 10309:2016
[4] Petersen, P.; Emnéus, H.: The Ferroxyle Test as a General Test of the Corrosiveness of Surgical Appliances Made from Stainless Steel or Co-Based Alloys of Stellite- Type, Mainly Vitallium and Neutrilium, Acta Orthopaedica Scandinavica, 29(1959)1-4, 1959, 331–340, https://doi.org/10.3109/17453675908988808
[5] Lehmann, J.; Burkert, A.; Müller, T.; Bohlmann, T.; Burkert, A.: Schlussbericht zu dem IGF-Vorhaben 17136 N/1 Detektion korrosionsempfindlicher Oberflächen nichtrostender Stähle durch die Verarbeiter, verfügbar auf researchgate.net
[6] Patentschrift DE 10 2010 037 775 B4: Auflage für den Nachweis von korrosionsempfindlichen Metalloberflächen und Verfahren zum Nachweis von korrosionsempfindlichen Metalloberflächen, Patent erteilt am 8.5.2014
[7] Rosemann, P.; Kauss, N.; Heyn, A.: KorroPad-Prüfung – Anwendungen aus Industrie und Forschung, 3-Länder-Korrosionstagung – Korrosion ist kein Zufall – Neue Messmethoden, Analytik und Simulation, Mai 2019, Frankfurt a. Main, verfügbar auf researchgate.net
[8] Rosemann, P.; Müller, T.; Babutzka, M.; Heyn, A.: Influence of microstructure and surface treatment on the corrosion resistance of martensitic stainless steels 1.4116, 1.4034, and 1.4021, Materials and Corrosion, 66, (2015), 45–53, https://doi.org/10.1002/maco.201307276
[9] Reinemann, S.; Babutzka, M.; Rosemann, P.; Lehmann, J.; Burkert, A.: Influence of grinding parameters on the corrosion behavior of austenitic stainless steel, Materials and Corrosion, 70,( 20199, 1776–1787, https://doi.org/10.1002/maco.201910874
[10] Kauss, N.; Heyn, A.; Halle, T.; Rosemann, P.: Detection of sensitisation on aged lean duplex stainless steel with different electrochemical methods, Electrochimica Acta 317 (2019) 17–24, https://doi.org/10.1016/j.electacta.2019.05.081
[11] Newton, C.J.; Sykes, J.M.: A galvanostatic pulse technique for investigation of steel corrosion in concrete, Corrosion Science, 28(1988) Nr. 11, 1051–1074, https://doi.org/10.1016/0010-938X(88)90101-1
[12] Spark, A.J.; Cole, I.; Law, D.; Ward, L.: The effect of peptide based nutrients on the corrosion of carbon steel in an agar based system, Corrosion Science 110, (2016), 174–181, https://doi.org/10.1021/acs.est.7b00437
[13] Spark, A. J.; Cole, I.; Law, D.; Marney, D. and Ward, L.: Investigation of agar as a soil analogue for corrosion studies. Materials and Corrosion 67 (2016), 7–12, https://doi.org/10.1002/maco.201508312
[14] Spark, A.J.; Law, D.W.; Ward, L.P.; Cole, I.S.; Best, A.S.: Effect of Pseudomonas fluorescens on Buried Steel Pipeline Corrosion, Environmental Science & Technology, 51(2017)15, 8501–8509, https://doi.org/10.1021/acs.est.7b00437
[15] Vanbrabant, J.; van de Velde, N.: Industrial application of an electrochemical corrosion test using a gel matrix as simulation for atmospheric and solid media, Proceedings: European General Galvanizers Association Intergalva Berlin, Vol. 19, June 7th, 2000, 29/1 to 29/13
[16] Shao, X.M.; Feldman, J.L.: Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials, Journal of Neuroscience Methods 159, (20079, 108–115, https://doi.org/10.1016/j.jneumeth.2006.07.001
[17] Monrrabal, G.; Guzmán, S.; Hamilton, I.E.; Bautista, A.F.; Velasco, F.: Design of gel electrolytes for electrochemical studies on metal surfaces with complex geometry, Electrochimica Acta, Volume 220, December 2016, 20–28, http://dx.doi.org/10.1016/j.electacta.2016.10.081
[18] Monrrabal, G.; Ramírez-Barat, B.; Bautista, A.; Velasco, F.; Cano, E.: Non-Destructive Electrochemical Testing for Stainless-Steel Components with Complex Geometry Using Innovative Gel Electrolytes. Metals,8, (2018), 500, https://doi.org/10.3390/met8070500
[19] Monrrabal, G.; Huet, F.; Bautista, A.: Electrochemical noise measurements on stainless steel using a gelled electrolyte, Corrosion Science, Volume 148, March 2019, Pages 48–56, https://doi.org/10.1016/j.corsci.2018.12.004
[20] Monrrabal, G.; Bautista, A.; Valesco F.: Use of Innovative Gel Electrolytes for Electrochemical Corrosion Measurements on Carbon and Galvanized Steel Surfaces, CORROSION, Vol. 75, No. 12, December 2019, 1502–1512, https://doi.org/10.5006/3309
[21] Cano, E.; Crespo, A.; Lafuente, D.; Ramirez Barat, B.: A novel gel polymer electrolyte cell for in-situ application of corrosion electrochemical techniques, Electrochemistry Communications, 41 (2014), 16–19, https://doi.org/10.1016/j.elecom.2014.01.016
[22] Di Turo, F.; De Vito, C.; Coletti, F.; Mazzei, F.; Antiochia, R.; Favero, G.: A multi-analytical approach for the validation of a jellified electrolyte: Application to the study of ancient bronze patina, Microchemical Journal, Vol. 134, 2017, 154–163, https://doi.org/10.1016/j.microc.2017.05.015
[23] Babutzka, M.; Burkert, A.; Heyn, A.: Korrosionsuntersuchungen mit gelartigen Elektrolyten zur Beschreibung der Korrosionsschutzwirkung von Zinküberzügen, 16. Sommerkurs Werkstoffe und Fügen: Magdeburg, 8. und 9. September 2017, 119–128, http://dx.doi.org/10.25673/5002
[24] Babutzka, M.; Heyn, A.: Dynamic tafel factor adaption for the evaluation of instantaneous corrosion rates on zinc by using gel-type electrolytes, IOP Conf. Ser.: Mater. Sci. Eng. 181, (2017), 012021, https://doi.org/10.1088/1757-899X/181/1/012021
[25] Labille, J.; Fatin-Rouge, N.; Buffle, J.: Local and Average Diffusion of Nanosolutes in Agarose Gel: The Effect of the Gel/Solution Interface Structure, Langmuir, 23, (2007), 2083–2090, https://doi.org/10.1021/la0611155
[26] Vaucher, S.; Li, M.; Mann, S.: Synthesis of Prussian Blue Nanoparticles and Nanocrystal Superlattices in Reverse Microemulsions, Angew. Chem. Int. Ed., 39, 1793–1796 http://www.doi.org/10.1002/(SICI)1521-3773(20000515)39:10<1793::AID-ANIE1793>3.0.CO;2-Y
[27] Ogston, A.G.; Preston, B.N.; Wells, J.D.: On the transport of compact particles through solutions of chain polymers, Proc. R. Soc. London, A. 1973333, (19739, 297–316, https://doi.org/10.1098/rspa.1973.0064
[28] Somma, M.; Querci M.: The Analysis of Food Samples for the Presence of Genetically Modified Organisms, Session 5: Agarose Gel Electrophoresis, 62, https://doi.org/10.2760/5277
[29] Normentwurf für ein Prüfverfahren zur Bestimmung von Deckschichtwiderständen an Zinküberzügen mittels Gel-artiger Elektrolyte – GELELEK, Forschungsvorhaben in der Forschungsinitiative des BMWi WIPANO, Projektträger Jülich, Berlin
[30] Killik, A.: Einflussfaktoren auf die Korrosion von unterschiedlich verzinkten Stahlprüfkörpern in Kurzzeitkorrosionstests und im Feld, Dissertation, Otto-von-Guericke-Universität Magdeburg, 2016
[31] J.R. Scully: Polarization Resistance Method for Determination of Instantaneous Corrosion Rates, Corrosion Vol. 56, (2000) Nr. 2, 199–218, NACE International, https://doi.org/10.5006/1.3280536
[32] ASTM G3−14: Standard Practice for Conventions Applicable to Electrochemical Measurements in Corrosion Testing, Reapproved 2019
[33] DIN EN ISO 9223:2012: Korrosion von Metallen und Legierungen – Korrosivität von Atmosphären – Klassifizierung, Bestimmung und Abschätzung
[34] Heyn A.: Bewertung der Korrosivität von Atmosphären anhand von Wetterdaten, 16. Sommerkurs Werkstoffe und Fügen: Magdeburg, 8. und 9. September 2017, 129–138, http://dx.doi.org/10.25673/5002


