4 Korrosionsdiagnostik mit Agar-Gelen
4.1 Verwendung von Gel-Elektrolyten mit Indikatoren
Farb-Indikatoren für den Nachweis bestimmter Ionenspezies werden seit langer Zeit genutzt, um das Vorhandensein, die Reaktionsorte oder auch die Quantitäten der Spezies einfach zu ermitteln. Diese einfachen elektrografischen Nachweisverfahren lassen sich für die Korrosionsdiagnostik ausnutzen, in dem man die Korrosivität des Elektrolyten ganz gezielt auf den Nachweis kritischer Fehlstellen oder Materialinhomogenitäten einstellt. Der wässrige Elektrolyt mit einer bestimmten Korrosivität und einem Indikator wird dann für eine bestimmte Zeit auf der Oberfläche appliziert. Als Träger des Elektrolyten werden häufig Filterpapiere empfohlen, wobei gel-artige Elektrolytträger, z. B. auf Agar-Basis, deutliche Vorteile aufweisen. Für die Abbildungsqualität einer Farbindikation ist die Beweglichkeit der komplexierten Stoffe im Elektrolytträger verantwortlich, die, wie Abbildung 5 zeigt, maßgeblich von der Porengröße abhängt. In Abbildung 6 sind drei verschiedene Elektrolytträger mit einem wässrigen Elektrolyten aus 10 mmol/L NaCl und 1 mmol/L Kaliumhexacyanoferrat nach 15-minütiger Auflage auf einem Stahlblech mit einer Eisenphosphatierung (0,6–1 g/m2) dargestellt.
![Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4 Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4](/images/stories/Abo-2022-01/gt-2022-01-0050.jpg) Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4
Abb. 5: Visualisierung der Diffusionshemmung unterschiedlich großer sphärischer Teilchen in Abhängigkeit der Porengröße gel-artiger Medien nach Ogston [27] und der Formel in Abbildung 4
Über Poren und andere Fehlstellen in der Phosphatschicht hat der Elektrolytfilm Zugang zum Stahl und ermöglicht dort das Lösen von Eisenionen in den Elektrolyten. Die Eisenionen wandern in den Elektrolytträger und werden komplexiert, was zur Bildung von Berliner Blau führt und das Vorhandensein sowie Ort, Anzahl und Größe der Poren indiziert. Die Qualität einzelner Anzeigen ist jedoch sehr unterschiedlich. Bei einem Filterpapier mit 15 µm Porengröße (Abb. 6c) verschwimmen einzelne Anzeigen zu einer fast flächigen Blaufärbung. Bei geringerer Porengröße hingegen wird der Farbkomplex stärker immobilisiert. Bei 1,5 µm (Abb. 6b) sind bereits einzelne Anzeigen gut erkennbar und ein Verlaufen der Anzeigen tritt nicht mehr so stark auf. Der Kontrast und die Anzeigeschärfe steigen jedoch nochmals deutlich bei der Verwendung eines Agar-Gels mit 3 % Agar als Gel-Bildner (Abb. 6a), das einen Porendurchmesser von ca. 0,165 µm aufweist. In Abbildung 5 wurde bereits die Hemmung des Stofftransports modellhaft dargestellt und man kann sich die verbesserte Anzeigenschärfe durch die stärkere Immobilisierung des Berliner Blau Pigments damit erklären.
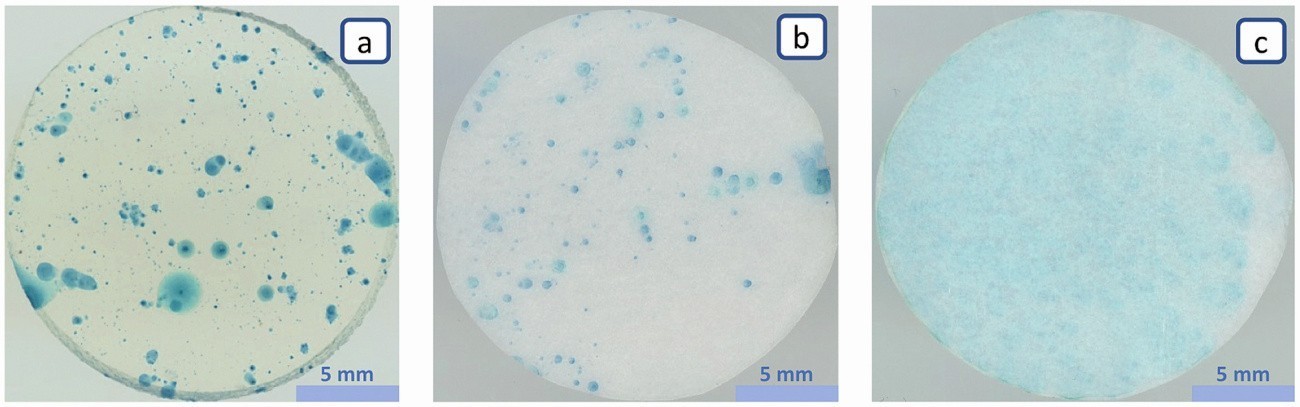 Abb. 6: Vergleich verschiedener Elektrolytträger mit unterschiedlichen Porengrößen nach 15-minütiger Auflage auf einem Stahl mit einer Eisenphosphatierung, a) 3%-iges Agar-Gel mit 0,165 µm Poren, b) Filterpapier mit 1,5 µm Poren, c) Filterpapier mit 15 µm Poren
Abb. 6: Vergleich verschiedener Elektrolytträger mit unterschiedlichen Porengrößen nach 15-minütiger Auflage auf einem Stahl mit einer Eisenphosphatierung, a) 3%-iges Agar-Gel mit 0,165 µm Poren, b) Filterpapier mit 1,5 µm Poren, c) Filterpapier mit 15 µm Poren
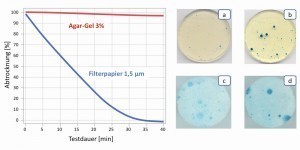 Abb. 7: Veränderung der Prüfmittel im Zeitraum von 40 min durch Abtrocknung und Auswirkung auf die Anzeige von Schwachstellen in der Passivschicht des nichtrostenden Stahls X2CrNi18-10 mit erhöhtem Schwefelgehalt, Prüfzeit 15 min, a) Gelpad mit 0,1 mol/L NaCl, b) Gelpad mit 0,3 mol/L NaCl, c) Filterpapier mit 0,1 mol/L NaCl, d) Filterpapier mit 0,3 mol/L NaCl (Gehalte an Kaliumhexacyanoferrat siehe Text) Gegenüber Filterpapier hat die Verwendung gel-artiger Elektrolytträger einen weiteren entscheidenden Vorteil. Die Gele bleiben länger gleichmäßig feucht und halten die Elektrolytkonzentration für die Dauer des Tests konstant. Filterpapiere dagegen nehmen weniger Elektrolyt auf und geben diesen deutlich schneller ab, wodurch sich die Elektrolytkonzentration im Testverlauf schnell verändert. Vor allem bei Anwendungen, bei denen die Korrosivität durch die Ionenkonzentration besonders kritisch ist, z. B. bei passiv vorliegenden nichtrostenden Stählen im Kontakt mit einem chloridhaltigen Elektrolyten, sind die Auswirkungen dramatisch. Abbildung 7 zeigt den Vergleich zwischen Gel-Elektrolyt und Filterpapier mit jeweils 0,1 und 0,3 mol/L NaCl sowie jeweils 1 und 3 mmol/L Kaliumhexacyanoferrat. Durch das Abtrocknen des Filterpapiers verliert der Elektrolyt in 10 min fast 40 % an Wasser und die NaCl-Konzentration steigt dementsprechend an. Man sieht, dass im Gegensatz zum konstant feuchten Gel ein differenziertes Prüfen der Lochkorrosionsbeständigkeit mit Filterpapieren nicht möglich ist, da beim zunächst geringen Chloridgehalt aufgrund der Aufkonzentration nach kurzer Zeit ebenfalls starke Lochkorrosion festgestellt wird.
Abb. 7: Veränderung der Prüfmittel im Zeitraum von 40 min durch Abtrocknung und Auswirkung auf die Anzeige von Schwachstellen in der Passivschicht des nichtrostenden Stahls X2CrNi18-10 mit erhöhtem Schwefelgehalt, Prüfzeit 15 min, a) Gelpad mit 0,1 mol/L NaCl, b) Gelpad mit 0,3 mol/L NaCl, c) Filterpapier mit 0,1 mol/L NaCl, d) Filterpapier mit 0,3 mol/L NaCl (Gehalte an Kaliumhexacyanoferrat siehe Text) Gegenüber Filterpapier hat die Verwendung gel-artiger Elektrolytträger einen weiteren entscheidenden Vorteil. Die Gele bleiben länger gleichmäßig feucht und halten die Elektrolytkonzentration für die Dauer des Tests konstant. Filterpapiere dagegen nehmen weniger Elektrolyt auf und geben diesen deutlich schneller ab, wodurch sich die Elektrolytkonzentration im Testverlauf schnell verändert. Vor allem bei Anwendungen, bei denen die Korrosivität durch die Ionenkonzentration besonders kritisch ist, z. B. bei passiv vorliegenden nichtrostenden Stählen im Kontakt mit einem chloridhaltigen Elektrolyten, sind die Auswirkungen dramatisch. Abbildung 7 zeigt den Vergleich zwischen Gel-Elektrolyt und Filterpapier mit jeweils 0,1 und 0,3 mol/L NaCl sowie jeweils 1 und 3 mmol/L Kaliumhexacyanoferrat. Durch das Abtrocknen des Filterpapiers verliert der Elektrolyt in 10 min fast 40 % an Wasser und die NaCl-Konzentration steigt dementsprechend an. Man sieht, dass im Gegensatz zum konstant feuchten Gel ein differenziertes Prüfen der Lochkorrosionsbeständigkeit mit Filterpapieren nicht möglich ist, da beim zunächst geringen Chloridgehalt aufgrund der Aufkonzentration nach kurzer Zeit ebenfalls starke Lochkorrosion festgestellt wird.
Ein weiterer Vorteil ist der deutlich bessere Kontrast und die scharfe Abbildung der Anzeigen. Dadurch hat man die Möglichkeit, die Bilder nachträglich einer halb-automatischen Bildanalyse zu unterziehen, die z. B. auf Farbraumauftrennung und dem Erkennen runder Objekte basiert. Die Verwendung von Filterpapieren liefert keine brauchbaren Eingangsdaten für die Bildanalyse. Aus den Bildern der Gel-Pads lassen sich jedoch sofort Daten zur weiteren digitalen Verarbeitung generieren, wie Abbildung 8 verdeutlicht. Bei der Detektion lokaler Schwachstellen, wie z. B. Poren in Phosphatierungen oder Lochkorrosion bei passiven Oberflächen, lässt sich die Anzahl der Anzeigen und deren prozentualer Flächenanteil bestimmen. Ebenso ist eine Klasseneinteilung nach der Größe der Anzeigen möglich, wodurch sich die Fehlerarten unterscheiden lassen. Eine große Anzeige ist mit einer längeren und stärkeren Metallauflösung und damit größeren Defekten verbunden. Bei kleineren Anzeigen ist die Metallauflösung an der Stelle deutlich geringer, d.h. die Defekte sind entweder kleiner, entstehen später, wachsen langsamer oder repassivieren. Die Ausbreitung der freiwerdenden Eisenionen erfolgt in alle Richtungen in das Gel hinein und reagiert dort mit dem Indikator. Dadurch entstehen kreisrunde Anzeigen. An länglichen Fehlern oder Verletzungen der Schicht kann dies zu perlenschnurartigen Anzeigen kommen, die in der Bildverarbeitung häufig als eine große Anzeige erkannt werden.
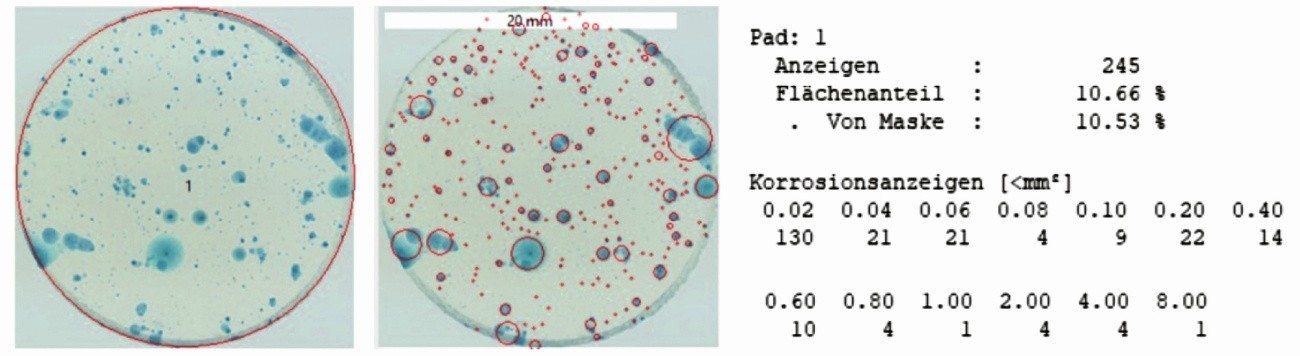 Abb. 8: Halb-automatische digitale Bildanalyse auf Basis von Farbraumauftrennung und Objekterkennung für das Gel-Pad aus Abbildung 6a, bestimmt werden Anzahl und Flächenanteil der Anzeigen sowie eine Einteilung der Anzeigen nach ihrer Größe (Klassierung)
Abb. 8: Halb-automatische digitale Bildanalyse auf Basis von Farbraumauftrennung und Objekterkennung für das Gel-Pad aus Abbildung 6a, bestimmt werden Anzahl und Flächenanteil der Anzeigen sowie eine Einteilung der Anzeigen nach ihrer Größe (Klassierung)
4.2 Verwendung von Gel-Elektrolyten für elektrochemische Messungen
Die Verwendung von Indikatoren in Gel-Elektrolyten zur Anzeige von Metallkationen aus Korrosionsreaktionen hat den Nachteil, dass dafür eine relativ hohe Metallauflösung notwendig ist. Außerdem muss die Grenze, ab der z. B. eine ausreichend dichte Schutzschicht vorliegt oder eine Passivschicht beständig ist, über die Korrosivität des Gels gezielt eingestellt und somit vorab bestimmt werden. Vielfach ist es jedoch gewünscht, eine Oberfläche nahezu zerstörungsfrei zu analysieren, oder eine quantitative Aussage zum Grad der Beständigkeit bzw. zur momentanen (häufig sehr niedrigen) Korrosionsgeschwindigkeit zu erhalten. Für diese Fragestellungen ist die Anwendung elektrochemischer Messmethoden prädestiniert, die rein analytisch für die Korrosionsdiagnostik eingesetzt werden. Die zu prüfende Oberfläche soll dabei so wenig wie möglich durch die Messung selbst verändert werden. Erreicht wird dies einerseits durch die richtige Wahl der Messmethode und der Messparameter. Günstig wirkt sich aber auch der Gel-Elektrolyt mit seinen Eigenschaften aus. So wird nicht nur die Sensorik einfacher, da keine flüssigen Elektrolyten mehr verwendet werden, sondern die Korrosivität lässt sich noch weiter herabsetzen. Nachfolgend werden einige Beispiele aufgeführt, bei denen Gel-Elektrolyte bereits erfolgreich mit elektrochemischen Messmethoden für die Korrosionsdiagnostik verwendet wurden.
4.2.1 Vereinfachung der Sensorik für Labor- und Feldanwendungen
 Abb. 9: Vereinfachung des Messaufbaus für elektrochemische Messungen mit Gel-Elektrolyten, links: frei aufliegendes Gel kontaktiert mit Gegen- und Bezugselektrode, rechts: Prototyp eines Sensors für point-of-care Anwendungen mit planarer Elektrodenankopplung und definiertem Anpressdruck Der Gel-Elektrolyt hat den Vorteil, dass die Ankopplung an die Probe oder das Messobjekt einfacher realisiert werden kann, da keine abdichtende Zelle notwendig ist, um ein Auslaufen des Elektrolyten zu verhindern. Für so genannte point-of-care-Anwendungen, d.h. direkt an realen Bauteilen in der Produktion oder an Strukturen im Außenbereich, kann man mit solch einem Sensor vor Ort Messungen durchführen, auch an senkrechten Strukturen oder Über-Kopf. Abbildung 9 zeigt den vereinfachten Messaufbau, wie er häufig im Labor realisiert wird (links) und einen Sensor für Feldanwendungen (rechts). Die Bezugs- und Gegenelektrode wird auf einer Seite des Gels angekoppelt, die Probe auf der anderen Seite. Der An- pressdruck wird dabei kontrolliert bzw. durch ein Feder-Element im Sensor realisiert, damit das Gel einen gleichmäßigen Kontakt zur Prüffläche hat, aber nicht zerdrückt wird. Ist das Versuchsobjekt magnetisch, wie z. B. verzinkter Stahl, kann die Befestigung des Sensors an der Prüffläche durch Magnete erfolgen.
Abb. 9: Vereinfachung des Messaufbaus für elektrochemische Messungen mit Gel-Elektrolyten, links: frei aufliegendes Gel kontaktiert mit Gegen- und Bezugselektrode, rechts: Prototyp eines Sensors für point-of-care Anwendungen mit planarer Elektrodenankopplung und definiertem Anpressdruck Der Gel-Elektrolyt hat den Vorteil, dass die Ankopplung an die Probe oder das Messobjekt einfacher realisiert werden kann, da keine abdichtende Zelle notwendig ist, um ein Auslaufen des Elektrolyten zu verhindern. Für so genannte point-of-care-Anwendungen, d.h. direkt an realen Bauteilen in der Produktion oder an Strukturen im Außenbereich, kann man mit solch einem Sensor vor Ort Messungen durchführen, auch an senkrechten Strukturen oder Über-Kopf. Abbildung 9 zeigt den vereinfachten Messaufbau, wie er häufig im Labor realisiert wird (links) und einen Sensor für Feldanwendungen (rechts). Die Bezugs- und Gegenelektrode wird auf einer Seite des Gels angekoppelt, die Probe auf der anderen Seite. Der An- pressdruck wird dabei kontrolliert bzw. durch ein Feder-Element im Sensor realisiert, damit das Gel einen gleichmäßigen Kontakt zur Prüffläche hat, aber nicht zerdrückt wird. Ist das Versuchsobjekt magnetisch, wie z. B. verzinkter Stahl, kann die Befestigung des Sensors an der Prüffläche durch Magnete erfolgen.
Einhergehend mit der Vereinfachung der Sensorik stellt sich auch die Frage, welche elektrochemischen Messmethoden man verwenden kann bzw. sollte. Pauschal ist dies nicht zu beantworten, da es von der jeweiligen Fragestellung und konkreten Anwendung abhängt. Letztlich dient die Elektrochemie in der Korrosionsforschung der Analyse eines Korrosionssystems. Dabei kann man entweder minimal-invasiv vorgehen, d.h. eine Kennwertermittlung mit dem Ziel durchführen, das System dabei nicht wesentlich zu verändern. Man hat aber genauso die Möglichkeit, das zu untersuchende System durch Polarisation gezielt in einen kritischen Bereich zu bringen und dann dessen Reaktion darauf zu überprüfen. Ein Beispiel wäre das gezielte Hervorrufen von Lochkorrosion bei nichtrostenden Stählen an einem kritischen Potential. Beide Strategien sind auch mit Gel-Elektrolyten umsetzbar, jedoch unterliegt das Hervorrufen von Korrosion ganz wesentlich den Eigenheiten des Gel-Elektrolyten, d.h. die Veränderung des Stofftransports durch das Gel beeinflusst entscheidend den Verlauf der Korrosion und das Aussehen der Korrosionserscheinungen.
Für Anwendungen, die auf eine minimal-invasive Beschreibung eines Korrosionssystems abzielen, ist die Hemmung der Stofftransportprozesse bei Gel-Elektrolyten ein Vorteil. Da die Korrosionsreaktionen anfangs gehemmt ablaufen, bleibt der Zustand der untersuchten Oberfläche länger konstant und analysierbar. Das macht es überhaupt erst möglich, Messmethoden anzuwenden, die ein längeres Analyse-Zeitfenster haben, wie z. B. die Impedanzspektroskopie (mehrere Minuten, abhängig von der tiefsten Frequenz). Um auch bei der elektrochemischen Messung die Oberfläche möglichst wenig zu verändern, ist die Auswahl der Messparameter wichtig. Zur Bestimmung eines momentanen Korrosionsstromes manipuliert man üblicherweise Strom oder Potential (sprunghaft, linear-dynamisch oder als Sinusschwingungen einer bestimmten Frequenz) und misst dabei den jeweiligen Gegenpart (Potential oder Strom). Als Faustformel kann man sagen, dass die jeweilige Anregungs-Amplitude nie höher sein sollte als der zu erwartende Korrosionsstrom, damit keine Beeinflussung des Korrosionssystems erfolgt. Hat man schließlich einen Kennwert in Form einer Stromdichte oder eines flächenbezogenen Polarisationswiderstands bestimmt, lässt sich dieser für die Bewertung des untersuchten Systems weiterverwenden. Es ist damit möglich, das Vorhandensein und die Schutzwirkung von Schichten zu beurteilen oder eine Vorhersage zum weiteren Korrosionsverlauf vorzunehmen. In den nachfolgenden Beispielen werden konkrete Anwendungen dazu vorgestellt.
4.2.2 Nachweis von volatilen Korrosionsinhibitoren (VCI) auf Stahl
Dampfphasen- oder auch flüchtige Korrosionsinhibitoren (volatile corrosion inhibitors – VCI) werden oft als Teil einer temporären Korrosionsschutz-Strategie für den Schutz von Metallteilen in Verpackungen und in der Lagerhaltung verwendet. Die Überprüfung des Vorhandenseins und der Wirksamkeit der VCI direkt an Produkten oder in einer Verpackung ist aktuell noch nicht möglich. Die Wirksamkeitsprüfung erfolgt daher durch Aus- lagerungsversuche von Metallproben in abgeschlossenen Behältnissen, in denen sich VCI-Stoffe befinden. Die Bewertung des Schutzvermögens erfolgt nach den Versuchen durch einen Vergleich des Erscheinungsbildes der Proben mit vorgegebenen Korrosionsschaubildern. Die Anwendung elektrochemischer Methoden scheiterte bisher daran, dass bei Verwendung flüssiger Elektrolyte die wenigen Moleküllagen auf der Oberfläche den Untersuchungsbedingungen nicht standhielten und deshalb keine verwertbaren Ergebnisse zustande kamen. Dies ist nicht verwunderlich, da VCI in einer Atmosphäre wirken sollen und nicht als Inhibitor für ein wässriges Medium ausgelegt sind. Verwendet man statt wässriger Elektrolyte hingegen Gel-Elektrolyte, kann man den Abbau der VCI-Stoffe durch den Prüfelektrolyten soweit hinauszögern, dass elektrochemische Messungen möglich sind, anhand derer das Vorhandensein und die Wirkung der VCI nachgewiesen werden können. Zusätzlich ist eine kurzeitige und minimal-invasive elektrochemische Anregung zur Kennwertermittlung notwendig, damit die Phasengrenze durch die Messung so wenig wie möglich verändert wird, man aber noch ein verwertbares Messsignal erhält. Abbildung 10 zeigt eine Pulsmessung mit einer geringen Stromanregung (oberer Teil) von ±1 µA bei einem Gelpad von 6 mm Durchmesser (entspricht ca. ±3,5 µA/cm2 Gesamtamplitude). Im mittleren Teil ist der Verlauf des Korrosionspotentials zu sehen, dem die Polarisation durch die Stromimpulse überlagert ist. Lage und Verlauf des Potentials werden durch die wechselnde kathodische/anodische Anregung mit geringer Amplitude kaum verändert, d.h. der Einfluss auf das Korrosionssystem ist gering. Der Polarisationsanteil (unterer Teil) lässt sich aus dem Potentialverlauf extrahieren und damit die Gesamtpolarisation auswerten.
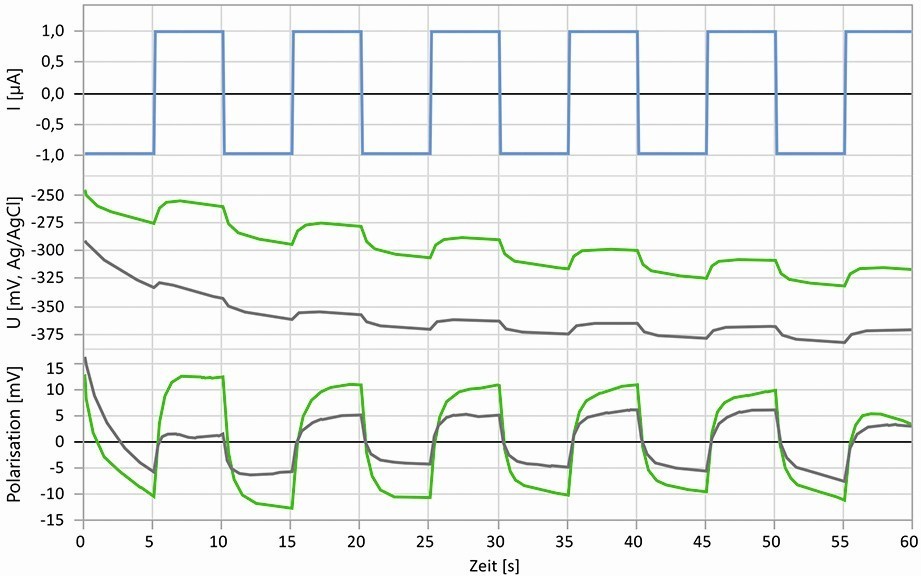 Abb. 10: Minimal-invasive galvanostatische Pulsmessungen über 60 Sekunden an unbehandeltem (grau) Stahl und Stahl bei Auslagerung in VCI-Atmosphäre (grün), oben: Anregung mit Pulsstrom, Mitte: Potentialverläufe, unten: Polarisationsverläufe
Abb. 10: Minimal-invasive galvanostatische Pulsmessungen über 60 Sekunden an unbehandeltem (grau) Stahl und Stahl bei Auslagerung in VCI-Atmosphäre (grün), oben: Anregung mit Pulsstrom, Mitte: Potentialverläufe, unten: Polarisationsverläufe
Die graue Kurve stellt die Messung an einer unbehandelten Stahloberfläche dar, die grüne Kurve wurde an einer Stahloberfläche aufgenommen, die zum Zeitpunkt der Messung für 24 h unter VCI-Atmosphäre gelagert wurde. Das Potential liegt für den VCI-behandelten Stahl deutlich positiver, was bereits auf eine Hemmung der Metallauflösung schließen lässt. Die Gesamtpolarisation ergibt bei der gewählten Stromanregung einen Polarisationswiderstand von ca. 3860 Ωcm2 gegenüber ca. 1715 Ωcm2 für den Zustand ohne VCI und zeigt die Hemmung der Korrosionsreaktionen und damit eine gewisse Schutzwirkung. Auf diese Weise lässt sich schnell und sicher nachweisen, dass die Oberfläche mit VCI belegt und ein Schutz vorhanden ist. Mit der Verwendung der in Abbildung 9 dargestellten Sensoren lassen sich solche Messungen auch einfach an Produkten oder in Verpackungen realisieren.
Dieses Beispiel verdeutlicht, dass mit der Verwendung gel-artiger Elektrolyte und minimal-invasiver elektrochemischer Methoden ein messtechnischer Zugang zu dieser Art von „unsichtbarer“ Oberflächenmodifizierung möglich wird. Ebenfalls denkbar sind z. B. die Überprüfung von Vor- und Nachbehandlungen von Metalloberflächen, insbesondere Systeme mit sehr geringen Schichtgewichten, die bereits bei mono-molekularer Belegung der Oberfläche eine Wirkung erzielen. Auch für Anwendungen bei denen dünne Filme abgeschieden werden oder Passiv- oder Konversionsschichten Teil einer Korrosionsschutzstrategie sind, ist die Korrosionsdiagnostik mit gel-artigen Elektrolyten anwendbar.
– wird fortgesetzt –
Literatur
[1] Laque, F.L.; May, T.P.; Uhlig, H.H.: Corrosion in Action, International Nickel Company Canada, 1955
[2] Isaacs, H.S.; Adzic, G.; Jeffcoate, C.S.: Visualizing Corrosion, Corrosion 56 (2000) 10, 971–978, https://doi.org/10.5006/1.3294386
[3] DIN EN ISO 10309:2016-08: Metallische Überzüge – Prüfverfahren zur Bestimmung der Porosität – Ferroxylprüfung (ISO 10309:1994), Deutsche Fassung EN ISO 10309:2016
[4] Petersen, P.; Emnéus, H.: The Ferroxyle Test as a General Test of the Corrosiveness of Surgical Appliances Made from Stainless Steel or Co-Based Alloys of Stellite- Type, Mainly Vitallium and Neutrilium, Acta Orthopaedica Scandinavica, 29, 1-4, 1959, 331–340, https://doi.org/10.3109/17453675908988808
[5] Lehmann, J.; Burkert, A.; Müller, T.; Bohlmann, T.; Burkert, A.: Schlussbericht zu dem IGF-Vorhaben 17136 N/1 Detektion korrosionsempfindlicher Oberflächen nichtrostender Stähle durch die Verarbeiter, verfügbar auf researchgate.net
[6] Patentschrift DE 10 2010 037 775 B4: Auflage für den Nachweis von korrosionsempfindlichen Metalloberflächen und Verfahren zum Nachweis von korrosionsempfindlichen Metalloberflächen, Patent erteilt am 8.5.2014
[7] Rosemann, P.; Kauss, N.; Heyn, A.: KorroPad-Prüfung – Anwen[1] dungen aus Industrie und Forschung, 3-Länder-Korrosionstagung – Korrosion ist kein Zufall – Neue Messmethoden, Analytik und Simulation, Mai 2019, Frankfurt a. Main, verfügbar auf researchgate.net
[8] Rosemann, P.; Müller, T.; Babutzka, M.; Heyn, A.: Influence of microstructure and surface treatment on the corrosion resistance of martensitic stainless steels 1.4116, 1.4034, and 1.4021, Materials and Corrosion, 66 (2015), 45–53, https://doi.org/10.1002/maco.201307276
[9] Reinemann, S.; Babutzka, M.; Rosemann, P.; Lehmann, J.; Burkert, A.: Influence of grinding parameters on the corrosion behavior of austenitic stainless steel, Materials and Corrosion, 70 (2019), 1776–1787, https://doi.org/10.1002/maco.201910874
[10] Kauss, N.; Heyn, A.; Halle, T.; Rosemann, P.: Detection of sensitisation on aged lean duplex stainless steel with different electrochemical methods, Electrochimica Acta 317 (2019) 17–24, https://doi.org/10.1016/j.electacta.2019.05.081
[11] Newton, C.J.; Sykes, J.M.: A galvanostatic pulse technique for investigation of steel corrosion in concrete, Corrosion Science, 28, (1988), Nr. 11, 1051–1074, https://doi.org/10.1016/0010-938X(88)90101-1
[12] Spark, A.J.; Cole, I.; Law, D.; Ward, L.: The effect of peptide based nutrients on the corrosion of carbon steel in an agar based system, Corrosion Science 110, 2016, 174–181, https://doi.org/10.1021/acs.est.7b00437
[13] Spark, A. J.; Cole, I.; Law, D.; Marney, D. and Ward, L.: Investigation of agar as a soil analogue for corrosion studies. Materials and Corrosion 67 (2016), S 7–12, https://doi.org/10.1002/maco.201508312
[14] Spark, A.J.; Law, D.W.; Ward, L.P.; Cole, I.S.; Best, A.S.: Effect of Pseudomonas fluorescens on Buried Steel Pipeline Corrosion, Environmental Science & Technology, 51 (15), 2017, 8501–8509, https://doi.org/10.1021/acs.est.7b00437
[15] Vanbrabant, J.; van de Velde, N.: Industrial application of an electrochemical corrosion test using a gel matrix as simulation for atmospheric and solid media, Proceedings: European General Galvanizers Association Intergalva Berlin, Vol. 19, June 7th, 2000, 29/1 to 29/13
[16] Shao, X.M.; Feldman, J.L.: Micro-agar salt bridge in patch-clamp electrode holder stabilizes electrode potentials, Journal of Neuroscience Methods 159, 2007, 108–115, https://doi.org/10.1016/j.jneumeth.2006.07.001
[17] Monrrabal, G.; Guzmán, S.; Hamilton, I.E.; Bautista, A.F.; Velasco, F.: Design of gel electrolytes for electrochemical studies on metal surfaces with complex geometry, Electrochimica Acta, 220 (2016), 20–28, http://dx.doi.org/10.1016/j.electacta.2016.10.081
[18] Monrrabal, G.; Ramírez-Barat, B.; Bautista, A.; Velasco, F.; Cano, E.: Non-Destructive Electrochemical Testing for Stainless-Steel Components with Complex Geometry Using Innovative Gel Electrolytes. Metals,8 (2018), 500, https://doi.org/10.3390/met8070500
[19] Monrrabal, G.; Huet, F.; Bautista, A.: Electrochemical noise measurements on stainless steel using a gelled electrolyte, Corrosion Science, Volume 148, March 2019, Pages 48–56, https://doi.org/10.1016/j.corsci.2018.12.004
[20] Monrrabal, G.; Bautista, A.; Valesco F.: Use of Innovative Gel Electrolytes for Electrochemical Corrosion Measurements on Carbon and Galvanized Steel Surfaces, CORROSION, 75 (2019), 12, 1502–1512, https://doi.org/10.5006/3309
[21] Cano, E.; Crespo, A.; Lafuente, D.; Ramirez Barat, B.: A novel gel polymer electrolyte cell for in-situ application of corrosion electrochemical techniques, Electrochemistry Communications, 41 (2014), 16–19, https://doi.org/10.1016/j.elecom.2014.01.016
[22] Di Turo, F.; De Vito, C.; Coletti, F.; Mazzei, F.; Antiochia, R.; Favero, G.: A multi-analytical approach for the validation of a jellified electrolyte: Application to the study of ancient bronze patina, Microchemical Journal, Vol. 134, 2017, 154–163, https://doi.org/10.1016/j.microc.2017.05.015
[23] Babutzka, M.; Burkert, A.; Heyn, A.: Korrosionsuntersuchungen mit gelartigen Elektrolyten zur Beschreibung der Korrosionsschutzwirkung von Zinküberzügen, 16. Sommerkurs Werkstoffe und Fügen: Magdeburg, 8. und 9. September 2017, 119–128, http://dx.doi.org/10.25673/5002
[24] Babutzka, M.; Heyn, A.: Dynamic tafel factor adaption for the evaluation of instantaneous corrosion rates on zinc by using gel-type electrolytes, IOP Conf. Ser.: Mater. Sci. Eng. 181, 2017, 012021, https://doi.org/10.1088/1757-899X/181/1/012021
[25] Labille, J.; Fatin-Rouge, N.; Buffle, J.: Local and Average Diffusion of Nanosolutes in Agarose Gel: The Effect of the Gel/Solution Interface Structure, Langmuir, 23 (2007), 2083–2090, https://doi.org/10.1021/la0611155
[26] Vaucher, S.; Li, M.; Mann, S.: Synthesis of Prussian Blue Nanoparticles and Nanocrystal Superlattices in Reverse Microemulsions, Angew. Chem. Int. Ed., 39, 1793–1796 http://www.doi.org/10.1002/(SICI)1521-3773(20000515)39:10<1793::AID-ANIE1793>3.0.CO;2-Y
[27] Ogston, A.G.; Preston, B.N.; Wells, J.D.: On the transport of compact particles through solutions of chain polymers, Proc. R. Soc. London, A. 1973333 (1973), 297–316, https://doi.org/10.1098/rspa.1973.0064
[28] Somma, M.; Querci M.: The Analysis of Food Samples for the Presence of Genetically Modified Organisms, Session 5: Agarose Gel Electrophoresis, 62, https://doi.org/10.2760/5277
[29] Normentwurf für ein Prüfverfahren zur Bestimmung von Deckschichtwiderständen an Zinküberzügen mittels Gel-artiger Elektrolyte – GELELEK, Forschungsvorhaben in der Forschungsinitiative des BMWi WIPANO, Projektträger Jülich, Berlin
[30] Killik, A.: Einflussfaktoren auf die Korrosion von unterschiedlich verzinkten Stahlprüfkörpern in Kurzzeitkorrosionstests und im Feld, Dissertation, Otto-von-Guericke-Universität Magdeburg, 2016
[31] J.R. Scully: Polarization Resistance Method for Determination of Instantaneous Corrosion Rates, Corrosion 56 (2000) Nr. 2, 199–218, NACE International, https://doi.org/10.5006/1.3280536
[32] ASTM G3−14: Standard Practice for Conventions Applicable to Electrochemical Measurements in Corrosion Testing, Reapproved 2019
[33] DIN EN ISO 9223:2012: Korrosion von Metallen und Legierungen – Korrosivität von Atmosphären – Klassifizierung, Bestimmung und Abschätzung
[34] Heyn A.: Bewertung der Korrosivität von Atmosphären anhand von Wetterdaten, 16. Sommerkurs Werkstoffe und Fügen: Magdeburg, 8. und 9. September 2017, 129–138, http://dx.doi.org/10.25673/5002


