Implantate für den Gesichtsbereich ermöglichen die chirurgische Korrektur von Deformationen nach Unfällen und Tumor-Entfernung sowie durch altersbedingten Knochenschwund. Derzeit kommen Kunststoff-Implantate zur Anwendung, die nicht auf die Anatomie des Patienten abgestimmt sind und erst während der Operation angepasst werden. Oftmals ungenügende Verankerung am Knochen birgt Risiken von Verschiebungen und damit Entstellungen sowie bakterielle Infektionsrisiken. Entwicklungsziel für temperatursensitive, auch 3D-druckbare Polymere, waren daher antimikrobielle Beschichtungen für optimales Knochenwachstum mittels Atmosphärendruck-Plasmaspritzen von Hydroxylapatit (HAp). Teil 1 eines Zweiteilers.
Gesichtsimplantate werden vielfach zur chirurgischen Korrektur von kosmetischen, traumatischen und kongenitalen Asymmetrien zumeist am Nasenrücken, Kinn und im Wangen-/ Kieferbereich angewendet – z. B. zur Korrektur krankheitsbedingter Fehlbildungen, Verlust von Knochen nach Tumorentfernungen, unfallbedingten Frakturen und alterungsbedingten Verlusten von Knochen- und Gewebsvolumina. Das Hauptziel der Behandlung ist ein vom Patienten akzeptiertes ästhetisches Ergebnis. Obwohl autologe Gewebe aus biokompatibler Sicht der Goldstandard sind, benötigen diese eine zweite Operationsstelle zur Gewebsentnahme und tragen das Risiko von Gewebsmorbidität an beiden Stellen, können vom umliegenden Knochen resorbiert werden und sind nur schwer in die gewünschte Form modellierbar. Daher werden überwiegend alloplastische, synthetische Materialien zum Ersatz für fehlendes Knochenvolumens implantiert, wobei diese biokompatibel, frei von signifikanten Fremdkörperreaktionen, stabil genug gegen physiologische Belastungen (Kräften beim Sprechen, Kauen und der Mimik) und zur Modellierung der Kontur prä- oder intraoperativ leicht formbar sein müssen [1]. Übliche Implantat-Materialien in der Gesichtschirurgie [2–4] sind bei hohen mechanischen Anforderungen wie z. B. im Kiefer Titan-Legierungen [5], bei geringerer zu erwartender Belastung Polymere wie expandiertes Polytetrafluorethylen (ePTFE, GoreTex) [6], Polyethylen-Terephtalat (PET) [7], Polyethylen ((HD-)PE) [8], Polypropylen (PP) [9] und Polydimethyl-Silikon [10]. Auch in-situ während der Operation geformte Knochenzemente aus PMMA und bioaktivem Hydroxylapatit [11] kommen zur Anwendung, wobei diese aber schlechte Planbarkeit des Ergebnisses durch die in-situ Formung haben. PE und Silikon sind durch ihre gute Formbarkeit in überwiegender Anwendung. Poröse Materialien (PE, ePTFE) ermöglichen bessere Gewebeintegration (Einwachsen von Knochenzellen), was aber bei etwaig notwendiger Implantatentfernung durch signifikante Gewebeverletzung des Weichgewebes und darunterliegenden Knochens und Fragmentierung des Implantats problematisch ist.
Eine falsche Platzierung bzw. Fixierung mit anschließender Migration/Rotation des Implantats und sichtbaren Konturveränderungen ist die häufigste Komplikation (bis zu 15 % der Fälle) [12, 13] – Migration/Rotation tritt dabei oft stark zeitverzögert auf und führt – wie auch die häufig auftretende Auswahl einer falschen Implantat-Größe – zu einer übermäßigen Belastung des umliegenden Gewebes und damit zu Neuropraxie (Fehlfunktion von Nerven durch Überdehnung), Ischämie, Nekrose oder Extrusion (Perfusion der überdeckenden Haut), Ödemen und Ekchymosen. Folgen sind chronische Schmerzreize und sichtbare Hämatome und Serome (abnormale Flüssigkeitsansammlungen). Letztere unterstützen das Bakterien- bzw. später auch Biofilm-Wachstum (dicke Schichten aus Bakterien) und lösen bakterielle Entzündungen des Weichteilgewebes und Knochens nahe am Implantat aus (Periimplantitis) [1]. Die meisten Infektionen im frühen postoperativen Zeitraum treten bei porösen Implantaten mit großen Oberflächen auf [2]. Infektionen, die Jahre nach der Operation unabhängig von der Implantat-Porosität auftreten, sind auf hämatogene Streuung von Bakterien (aus dem Dentalbereich [14]) oder direkte Verletzung der sich ausgebildeten Gewebsverkapselung um das bioinerte Implantat zurückzuführen. Explanationen werden bei starken Entzündungsreaktionen, aber auch bei Knochenresorption als Folge zu großer Druckbelastung nicht anatomisch angepasster Implantate erforderlich
Patientenspezifische Implantate aus generativer Fertigung – Verfahren und Verfügbarkeit biokompatibler (Polymer-)Materialien
Ausgehend von der kranio- / maxillofazialen Tumorchirurgie mit auftretenden starken Gesichts-Deformitäten zeigt sich auch für die generelle plastische Chirurgie im Gesichtsbereich die generative Fertigung (AM, „3DDruck“) von Implantaten als optimale Methode, um eine Vielzahl oben angeführter Komplikationen vermeiden zu können – speziell durch die perfekte Anpassbarkeit auf die patientenspezifische Anatomie der vorhandenen Knochen. Ausgehend von Computer-Tomographie-Daten (CT) werden 3D-Scaffolds in sehr komplexen Konturen virtuell erstellt, wozu zur (Re-)Konstruktion mit notwendiger hoher Genauigkeit [15, 16] neben kommerzielle Softwarepaketen von Materialise (Mimics, 3Matic), 3Dsystems (RapidForm, Geomagic) und Vision Imaging (Amira) auch hohe anatomisch-funktionale und chirurgische Erfahrung notwendig ist. Anschließend erfolgt die lagenweise Herstellung direkt aus einer Computer-AidedDesign-Datei durch Extrusion (z. B. Fused Deposition Modelling, FDM), Polymerisation (Stereolithographie), selektiv-lasergestütztes Schmelzen und Sintern (SLM, SLS) oder direkt schreibende Prozesse [17–23].
Bioresorbierbarkeit mit vollständigem Ersatz des Implantats durch körpereigenes Knochengewebe ist im Bereich der Gesichtschirurgie aufgrund des damit nicht detailliert im Voraus planbaren bzw. sich postoperativ noch ändernden ästhetischen Eindrucks nicht erwünscht. Eine Bioaktivität der Oberfläche zur Vermeidung der Komplikationen ist dabei jedoch von großer Bedeutung. Bioinert und gleichzeitig biokompatibel sind z. B. PEEK und verschiedene Photopolymere. PEEK ist jedoch durch seine hohe Schmelztemperatur mittels SLS und FDM nur sehr aufwendig zu fertigen, während 3D-Druck von Photopolymeren z. B. mit dem PolyJet-Verfahren, technisch einfacher, kostengünstiger und schneller ist. Dabei wird das flüssige Monomer durch einen Druckkopf mit mehreren Düsen auf eine Werkplattform aufgetragen und durch UV-Licht sofort ausgehärtet. Danach fährt die Plattform um die Dicke einer Schicht (16–32 µm) nach unten, und eine weitere Schicht wird auf die bereits ausgehärtete Schicht aufgetragen. Dieser Prozess wird so lange wiederholt, bis das Modell vollständig gedruckt ist. Tropfenförmiger Auftrag ermöglicht ein Zerlaufen vor dem Härtungsvorgang, wodurch von SLS und FDM bekannte Rillen im Werkstück nicht zu erkennen sind und sich eine glatte Oberfläche ausbildet. Das Verlaufen erfordert aber für überhängende Bereiche Support-Strukturen, die nach der Fertigung entfernt werden müssen [24].
Während mittels PolyJet-Verfahren gedruckte bioinerte (Gesichts-)Implantate zwar die Forderungen nach hoher dauerhafter patientenspezifischer Genauigkeit erfüllen, müssen Anforderungen hinsichtlich der Osteointegration zur Vermeidung von Rotation und Migration der Implantate sowie zum antimikrobiellen Schutz durch anschließende bioaktive Oberflächenmodifizierung erreicht werden.
Stand der Technik: Konzepte zur Verbesserung der Osteointegration und zur Vermeidung von bakteriellen Infektionen von implantierten Biomaterialien
Bioinerte Kunststoffe und Titan-Legierungen werden aufgrund ihrer Festigkeit, keiner auftretenden Gewebstoxizität (Zytotoxizität) und Biodegradations-/Korrosionsbeständigkeit überwiegend für Implantate verwendet. Die Langzeit-Implantation erfordert jedoch zur Vermeidung der Bildung fibröser Gewebskapseln um die Implantate und damit Entzündungen oder Implantat-Migration Oberflächeneigenschaften, d. h., z. B. Knochenzemente oder Beschichtungen aus den mineralischen Komponenten im Knochen sehr ähnliche Materialien, d. h. Calziumphosphate wie Hydroxylapatit (HAp) [25, 26]. In den letzten Jahrzehnten wurden speziell für metallische Implantate (Hüft-/Knie-Endoprothesen) verschiedene Beschichtungsverfahren für HAp-Beschichtungen (d. h., Plasma-/Thermisch Spritzen, Magnetronsputtern und ionenunterstützte Vakuumbeschichtung, Dip-Coating, Sol-Gel-Beschichtung, Elektrophorese) entwickelt [27].
In industrieller Anwendung sind auf Metallsubstraten derzeit fast ausschließlich Plasma- und thermisches Spritzen. Schlechte Haftung der Beschichtungen [28] und hohe (Nach-)Behandlungstemperaturen zur Erzielung notwendiger Phasen sind die Nachteile fast aller Verfahren. Für temperaturempfindliche Kunststoff-Substrate (d. h. ausgen. PEEK [29–31]) sind derzeit keine nutzbaren/haftfesten Beschichtungen verfügbar. Ausgezeichnete Schichthaftung [32] ist aber essentiell, welche hauptsächlich infolge des Abkühlens durch intrinsische Eigenspannungen und aufgrund von Bioresorption durch die vorliegenden Ca-P-Phasen an der Grenzfläche gesteuert wird.
Experimentelles – Atmosphärendruck Plasma-Spray-Beschichtung
In Atmosphärendruck-Plasma-Düsen (Plasma-Jets) wird generell mittels Hochspannungsentladung (5-15 kV, 10-100 Hz) ein gepulster Lichtbogen erzeugt, an welchem das Prozessgas vorbeiströmt und ionisiert wird. Der Austritt erfolgt punktförmig durch einen Düsenkopf als thermisches Heißgasplasma, welcher auf Massepotential liegt und damit potentialführende Teile des Plasmastromes weitgehend zurückhält. Speziell der innere Aufbau der Plasmadüse sowie die genutzte Anregungsspannung und -frequenz definiert die erzielbaren Plasmaeigenschaften (Dichte, Energie, etc.). Entscheidendes Know-how in der nachfolgend beschriebenen Materialentwicklung ist eine patentierte, aus der Plasmatron Plasmaschweißtechnologie hervorgegangene Heißgas-Plasmadüse von Inocon Technologie GmbH (InoCoat IC 3, Abb. 1), welche im Vergleich zu Mitbewerbern bei wesentlich geringerer Leistung und damit über einen deutlich größeren Leistungsbereich stabil arbeitet, was die Regelbarkeit von Plasma-Prozessen entscheidend verbessert (Patente EP0933982, EP0962277). Spezielles Know-how zur Elektroden- und Düsenform (inkl. Simulations-Methoden) und den Gasflüssen ermöglicht deutlich breitere laterale Homogenität des Plasmas. Dies verlängert die Plasmaverweil- sowie Reaktionszeiten von Partikeln, Gasen und Prekursoren bei optimiertem Zuführungspunkt und -winkel (Teil des Inocon-Patents DE1021014100385).
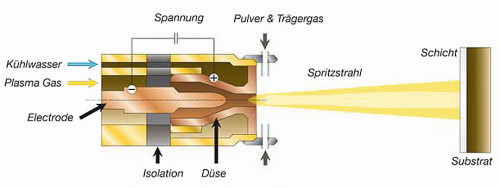 Abb. 1: Prinzipbild einer Heißgas-Plasmadüse von Inocon Technologie GmbH
Abb. 1: Prinzipbild einer Heißgas-Plasmadüse von Inocon Technologie GmbH
Vorteil der Atmosphärendruck-Plasma-Beschichtung ist die universelle Nutzbarkeit von gas- und dampfförmigen Precursoren zur Abscheidung für SiO2- [33–35], TiO2- [36, 37], und Polymer-Dünnschichten (siehe Übersicht in [35]) sowie die einfache und auch kombinierte Nutzbarkeit mit Dickschichtprozessen für Metall-, Oxid und Polymerschichten unter Verwendung von MikroPartikeln bzw. aufgesprühten flüssigen Precursoren (Atmosphärendruck-Plasmaspritzen). Speziell durch Anwendung von Pulvern im Atmosphärendruck-Plasmaspritz-Prozess kann die Stöchiometrie von komplexen keramischen Verbindungen (wie z. B. auch HAp) ähnlich wie bei Plasma- bzw. thermischen Spritzprozessen vergleichsweise einfach in Beschichtungen übergeführt werden. Bislang beschäftigten sich aber nur sehr wenige Publikationen und Patente mit diesen in ihrer Plasmaenergie sehr gut und über deutlich größere Bereiche als bei Spritzprozessen steuerbaren APPD-Plasmen zur Herstellung von keramischen Schichten auf Polymeren bzw. in Kombination mit Dünnschichtprozessen zur Haftungsoptimierung (d. h., für HAp mit Plasma-Jets generell nur auf hochtemperaturbeständigen PEEK-Kunststoff-Substraten [38]).
Im Zuge der Entwicklungsarbeiten kamen zwei verschiedene HAp-Pulvertypen (Ca5(PO4)3OH) mit bereits vorhandener medizinischer Zulassung von MediCoat (Mägenwil, Schweiz) zur Anwendung, welche sich in der Korngröße (63±15 µm bzw. 25±5 µm) aber nicht der chemischen Zusammensetzung unterscheiden.
Erfahrungsbasiert ermöglicht der eingesetzte IC3-Plasma-Jet von Inocon Technologie GmbH die Beschichtung sehr temperaturempfindlicher Substrate. Als biokompatibles Material mit Prüfungen nach ISO 10993 und bereits verfügbarer medizinischer Zulassung als Implantat-Werkstoff für Kurzzeit-Nutzung (bis 28 Tage) kam ein Urethan-Acrylat (Exo-1,7,7-Trimethyl-bicyclo(2.2.1)-hept-2-YL Acrylat) von Stratasys zur Anwendung, wobei glatte und hexagonal mikrostrukturierte ebene Proben mittels PolyJet-Technologie gedruckt wurden [39]. Dieses Polymer mit 65 MPa Zugfestigkeit, >20 % Bruchdehnung, < 3 GPa Elastizitätsmodul (ASTM D638), 30 J/m Izod Schlagzähigkeit (ASTM 256) dient als Basis der Entwicklungen, welche damit auch für zukünftige, dauerhaft implantierbare und 3D-druckbare Implantatwerkstoffe sowie auch für typische bereits jetzt angewendete Werkstoffe wie Polyetheretherketon (PEEK) und Polyetherketonketon (PEKK) anwendbar werden. Durch im Wasserbad vollständig entfernbares Stützmaterial lassen sich damit zudem komplexe überhängende und poröse Strukturen drucken.
Die detaillierten Beschreibungen der eingesetzten Charakterisierungsverfahren finden sich im nachfolgenden Abschnitt der Präsentation der Forschungsergebnisse.
Ergebnisse und Diskussion
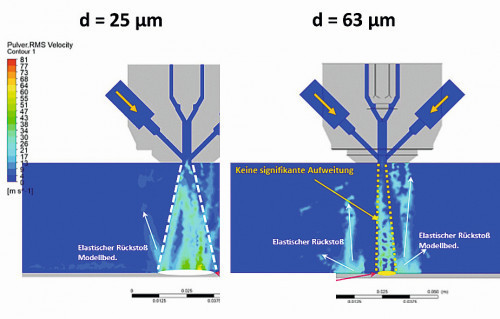 Abb. 2: Prozessmodellierung mit Digitalem Zwilling zur Pulverauswahl: Vergleich Partikelgeschwindigkeit, -temperatur u. aufgeschmolzenem Partikelanteil für 25 und 63 µm Pulver
Abb. 2: Prozessmodellierung mit Digitalem Zwilling zur Pulverauswahl: Vergleich Partikelgeschwindigkeit, -temperatur u. aufgeschmolzenem Partikelanteil für 25 und 63 µm Pulver
Als erster Schritt der Beschichtungsentwicklung erfolgte die Simulation der Vorgänge im Plasma in Abhängigkeit verschiedener Pulverkorngrößen des Hydroxylapatits.Dafür kommt der digitale Zwilling für den Inocon IC3-Plasma-Jet zur Anwendung, welcher auf einer für eine Vielzahl an Pulvern und Prekursoren validierten Computational-Fluid-Dynamics-Simulation basiert (Ansys Software 2019 R3, CFD). Damit lassen sich bereits vorab nützliche Erkenntnisse bezüglich der Partikelfluggeschwindigkeit, des Partikelaufschmelzverhaltens bzw. der Partikelverteilung erzielen. Verfügbare Materialeigenschaften der HAp-Pulver von MediCoat dienten neben den typischen Plasma-Jet-Parametern als Datenbasis. Die Ergebnisse der Diskussion – inkl. des Rückstreuverhaltens als Basis für die Abschätzung des entstehenden Oversprays – zeigt Abbildung 2, wo sehr gut der breitere Beschichtungskegel beim feineren Pulver zu erkennen ist. Die Auswertung als Gauß-Verteilung verdeutlicht, dass sich das Partikelgeschwindigkeitsspektrum am Ausgang der Plasmadüse für das feinere HAp-Pulver (25 µm) nach der Plasmadüse breiter verhält als jenes vom gröberen HAp-Pulver (63 µm). Die mittlere Partikelgeschwindigkeit vom feinen HAp-Pulver ist etwa 3x höher als jene vom gröberen HAp-Pulver. Ähnliches Verhalten kann für die erzielten Partikeltemperaturen vorausgesagt werden (d. h. ohne Berücksichtigung von Temperaturgradienten im Partikel aufgrund langsamer Wärmeleitung): Die mittlere Partikeltemperatur des feinen HAp-Pulvers beläuft sich auf etwa 700 K und jenes des gröberen HAp-Pulvers auf etwa 350 K. Folglich zeigt die Gauß-Verteilung für den mittleren flüssigen Phasenanteil des feineren HAp-Pulvers nur sehr geringe Werte (d. h. nur sehr wenige Partikel sind überwiegend aufgeschmolzen), während mit dem gröberen HAp-Pulver kein Flüssiganteil erzielt werden kann. Diese Ergebnisse wurden experimentell über die Beschichtungscharakteristik (z. B. als Schicht abgeschiedener Pulvergewichtsanteil vs. Overspray) mit durchschnittlich 20 % relativem Abweichungsbereich erfolgreich validiert.
Ausgehend von einer umfangreichen Parameterstudie zu den einstellbaren Prozessparametern beim Atmosphärendruck-Plasmaspritzen (Leistung des Plasma-Jets, Plasma- und Pulverförder-Gasflüsse, Pulverfluss, Abstände, Bewegungsgeschwindigkeiten, etc.) wurden stabile Prozessparameter gefunden, welche weder zunächst optisch (Verformung, Verfärbung nach Degradation) noch in detaillierter Oberflächenanalyse des ausgewählten Substratpolymers in Fourier-transformierter Infrarotspektroskopie (FTIR/ATR-Mode nach mechanischer Schichtentfernung) eine Substratschädigung mit sich führen. Auch zeigen Ergebnisse aus Scratch-Tests von bis zu 100 µm dicken Beschichtungen sehr gute Haftungseigenschaften ohne großflächige Delaminationen im Umfeld der Scratches.
Im Anschluss soll für diese ausgewählten Parameter ausreichend hohen Wärmeeintrags in die Partikel, aber nur geringem Wärmeeintrag in die Substratoberfläche über das Plasma selbst die Schichtbildungscharakteristik in Abhängigkeit des Wärmeeintrags diskutiert werden. Speziell diese wirkt sich entsprechend des State-of-the-Arts zu diesen Biomaterialien signifikant über die Phasenausbildung auf das anschließende biokompatible Verhalten (d. h. die Osteointegration) aus.
![Abb. 3: Links: Vorgänge beim der Abscheidung (Plasma-Spritzbeschichtung) eines teilweise aufgeschmolzenen HAp-Partikels, rechts: auftretende Phasen und Löslichkeiten (log KSP) beim Spritzen von HAp (nach [44]) Abb. 3: Links: Vorgänge beim der Abscheidung (Plasma-Spritzbeschichtung) eines teilweise aufgeschmolzenen HAp-Partikels, rechts: auftretende Phasen und Löslichkeiten (log KSP) beim Spritzen von HAp (nach [44])](/images/stories/thumbnails/thumb_gt-2023-01-034.jpg) Abb. 3: Links: Vorgänge beim der Abscheidung (Plasma-Spritzbeschichtung) eines teilweise aufgeschmolzenen HAp-Partikels, rechts: auftretende Phasen und Löslichkeiten (log KSP) beim Spritzen von HAp (nach [44])
Abb. 3: Links: Vorgänge beim der Abscheidung (Plasma-Spritzbeschichtung) eines teilweise aufgeschmolzenen HAp-Partikels, rechts: auftretende Phasen und Löslichkeiten (log KSP) beim Spritzen von HAp (nach [44])
Aus der Literatur ist bekannt, dass kristalline HAp-Ausgangspulver während Spritz-Beschichtungen (Plasmaspritzen, thermisch Spritzen) durch den Temperatureinfluss zu CaO, amorphem Calciumphosphat und α-TCP (Tricalciumphosphat) zerfallen können, welche alle deutlich höhere Löslichkeit in Körperflüssigkeiten (bzw. physiologische Kochsalzlösung) aufweisen und/oder schnell hydrolysieren, was sich hinsichtlich der Haftung am umgebenden Knochen nach der Implantation während der Ein- bzw. Anwachs-Phase negativ auswirkt [40]. Kristalliner HAp mit sehr geringer Löslichkeit wäre dabei der Optimalzustand (Tab. in Abb. 3). Zudem nimmt das spezifische Volumen zu und initiiert kohäsive und adhäsive Risse in den porösen Beschichtungen. β-TCP (durch Phasenübergang von α-TCP) löst sich bzw. hydrolysiert deutlich langsamer, während kristalliner c-HAp (HA in Abb. 3) am stabilsten ist [41]. Für hoch bioaktive, gut haftende Beschichtungen sollte daher stabiler c-HAp ausgebildet werden. Geringe Anteile von schneller resorbierbaren Phasen unterstützen dabei die Knochenneubildung. Kommt es beim thermischen oder Plasma-Spritzen zum starken Aufschmelzen des HAp im Plasma, unterdrücken hohe Abkühlraten nach der Splat-Abscheidung auf der Substratoberfläche jedoch die Kristallisation zu c-HAp auch nahezu vollständig (Abb. 3). Erst mehrmalige Temperaturbehandlung, wie dies infolge mehrerer Überfahrten beim Plasmaspritzen der Fall ist und damit die Temperatur des Substrates stark über längeren Zeiträume (Minuten-Bereich) erhöht, steigert den c-HAp-Gehalt [42, 43]. Dies ist jedoch für Polymere, aber auch für verzugsempfindliche, fein strukturierte z. B. TiAl6V4-Substrate nicht möglich. Die „Heat Deflection Temperature“ (HDT) liegt z. B. beim ausgewählten Urethan-Acrylat-Substrat bei 40–45 °C, die Glasübergangstemperatur bei 50–55 °C. Dies ist im Vergleich zu anderen derzeit eingesetzten technischen Polymeren mit Implantat-Nutzung (z. B. PEEK) sehr niedrig, aber typisch für viele biokompatible und resorbierbare zukünftige Medizintechnik-Polymere (z. B. medizinisch zugelassenem Polycaprolactan mit langsamer Degradation).


