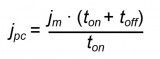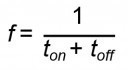Lithium
Lithium hat das niedrigste Standardpotential von -3,04 V vs. SHE (Standard-Wasserstoffelektrode) und eine hohe spezifische Kapazität von 3860 mA h g-1 und ist daher hervorragend als Elektrode für sekundäre Batterien (Akkumulatoren) mit hohen spezifischen Energien geeignet. Lithium wird anodenseitig üblicherweise in Form einer Folie in Batterien eingesetzt. Aufgrund der Schwierigkeiten bei der Handhabung des weichen Metalls ist die Verwendung sehr dünner Folien (Schichtdicke sd < 50 µm) schwierig [3]. Daher wird in bisherigen Batteriekonzepten deutlich mehr Lithium eingesetzt, als es elektrochemisch erforderlich wäre. Dies wirkt sich nicht nur negativ auf das Gewicht einer Zelle und damit mindernd auf die charakteristischen Kennwerte der Batterie aus, sondern ist auch mit einem erhöhten Sicherheitsrisiko verbunden [4]. Die Herstellung von dünnen Lithiumschichten mit wenigen Mikrometern Schichtdicke für die Verwendung in neuartigen Batteriesystemen ist daher eine wichtige Aufgabe für die zukünftige Energiespeicherung.
Ein mögliches Verfahren zur Herstellung dünner, homogener Lithiumschichten ist die galvanische Abscheidung, bei der Lithium elektrochemisch auf einem leitfähigen Substrat (z. B. Kupferfolie als Stromsammler) abgeschieden wird. Vorteile sind die geringen Prozesskosten, verbunden mit niedrigen Prozesstemperaturen, einer sehr guten Schichthaftung und einer gezielten Beeinflussbarkeit von Schichtstruktur, -dicke sowie -morphologie. Die galvanische Abscheidung von Lithium lässt sich mit einer hohen Kontrolle der Oberflächenmorphologie und der gewünschten Schichtdicke durchführen [5, 6].
Anfänge der Lithiumabscheidung
Im Zuge der ersten Publikationen zu Lithium-Ionen-Batterien Anfang der 1970er rückte auch die elektrochemische Abscheidung von metallischem Lithium in organischen Lösungsmitteln in den Fokus wissenschaftlicher Publikationen. Anfangs wurden verschiedene Salze wie Lithiumnitrat und Lithiumperchlorat, später Lithiumhexafluorophosphat und Lithiumtetrafluoroborat untersucht und es kamen organische Lösungsmittel wie Acetonitril, N,N-Dimethylformamid und später Alkylcarbonate wie Propylencarbonat zum Einsatz [7–9].
Tieferes Verständnis zum Mechanismus der Lithiumabscheidung brachte zusätzlich die Untersuchung der Passivschicht auf Lithium in Kontakt mit organischen Lösungsmitteln [10]. Lithium bildet, aufgrund seiner hohen Reaktivität, beim Kontakt mit einem Elektrolyten eine sogenannte Feststoff-Elektrolyt-Zwischenphase (Solid Electrolyte Interphase = SEI). Diese Schicht besteht aus Reaktionsprodukten zwischen Lithium und dem Elektrolyten, also anorganischen und organischen Verbindungen und ist ionisch leitfähig aber elektronisch isolierend [11]. Die SEI-Schicht schützt das Lithium vor weiterer „Korrosion“, führt allerdings bei inhomogenen Schichtdicken bei Abscheide-/Auflösevorgängen in der Batteriezelle zu lokalen Stromdichteunterschieden, durch die sich in Bereichen mit dünnerer SEI-Schicht verstärkt Lithium-Dendriten bilden können. Dies kommt u. a. dadurch zustande, dass sich die überschüssige Ladung an exponierten Lithium-
Kristalliten zentriert ansammelt und ein starkes elektrisches Feld erzeugt, das die Lithium-Ionen anzieht und ein vermehrtes Wachstum an dieser Stelle und dadurch das Wachstum von dendritischen Mikrostrukturen induziert [12]. Lithium neigt bei elektrochemischer Belastung leicht zur Bildung von dendritischen Strukturen. Die Neigung zu unkontrolliertem „nadelförmigen“ Wachstum kann in einer Batteriezelle zu gefährlichen Kurzschlüssen führen [13]. Zudem können derartige Lithiumstrukturen den Kontakt zur restlichen Elektrode verlieren und somit
Aktivmaterial verloren gehen. In der Literatur werden deshalb verschiedene Elektrolytzusätze diskutiert, die die SEI-Schicht stabilisieren und die Bildung von Lithium-Dendriten während der Abscheidung unterdrücken sollen. Hierzu gehören organische Zusätze [14, 15], Natriumsalze [6, 16], Kohlenstoffdioxid [17], Flusssäure [18, 19] bzw. Flusssäure bildende Additive wie Cäsiumhexafluorophosphat [20] und Wasser in Kombination mit Lithiumhexafluorophosphat als Lithiumsalz [21, 22].
Bei der Verwendung von Elektrolyten mit Lithiumhexafluorophosphat (LiPF6) ohne Zusatz von Wasser werden nur bei geringer Stromdichte (< 1 mA cm-2) kompakte Lithiumschichten ausgebildet. Allerdings ist das Elektrolytsystem bzw. die sich ausbildende SEI-Schicht vergleichsweise instabil und es können sich daher leicht dendritische Mikrostrukturen bei der Lithiumabscheidung bilden. Dies kann u. a. darauf zurückgeführt werden, dass der Einbau von Fluorophosphat-Anionen (PF6-) in die SEI-Schicht diese nicht ausreichend stabilisieren. Durch die Zugabe von einigen ppm Wasser als „Additiv“ zum Elektrolyten kann bei der Lithiumabscheidung die Oberflächenmorphologie und Schichtstruktur dagegen deutlich verbessert werden. Das zugegebene Wasser reagiert gemäß Gleichung <1> mit den Hexafluorophosphat-Ionen und bildet dabei Fluorwasserstoff (HF). Dieser ermöglicht die Bildung einer lithiumfluoridreichen SEI-Schicht und trägt zur weiteren Stabilisierung der SEI-Schicht bei, was eine dendritenfreie Abscheidung von Lithium ermöglicht.
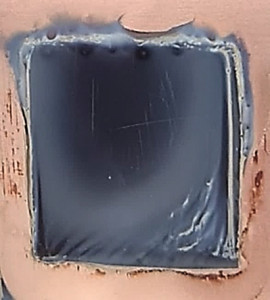
LiPF6 + H2O → POF3 + LiF + 2 HF Gl. <1>
Qian et al. haben die Wirkung von Wasserzusatz im ppm-Bereich in einem propylen-carbonat-basierten Elektrolyten mit LiPF6 genauer untersucht [21]. Bereits bei einer Zugabe von nur 10 ppm Wasser in den Elektrolyten wurde eine Veränderung der Oberflächen-morphologie der Lithiumabscheidungen im Vergleich zum ursprünglichen Elektrolyten beobachtet. Bei dieser geringen Zugabe von Wasser können jedoch noch dendritische Mikrostrukturen während der Abscheidung gebildet werden, die vor allem in den Ecken und an den Rändern der Proben sichtbar sind. Dies ist auf die nicht ausreichend dicke bzw. stabilisierte SEI-Schicht zurückzuführen, da der Fluorwasserstoff-Gehalt im Elektrolyten noch nicht ausreichend ist. Bei Zugabe von 25 ppm Wasser werden die dendritischen Mikrostrukturen bei der Abscheidung nicht mehr beobachtet. Bei Verdopplung der Wassermenge auf 50 ppm wurde neben den dendritenfreien Lithiumschichten ein weiterer Aspekt ersichtlich. Diese Lithiumschichten hatten ein metallisches Aussehen mit leuchtend dunkelblau-violetter Farbe. Dieser optische Effekt, der durch Wechselwirkung der Lithiumoberfläche mit sichtbarem Licht zustande kommt, ist auf eine gleichmäßige geordnete Säulenstruktur und Oberflächenmorphologie der abgeschiedenen Lithiumschichten zurückzuführen. Eine weitere Zugabe von Wasser von bis zu 250 ppm führt gemäß den Autoren nur zu vielen Oberflächendefekten, die durch granulare Ablagerungen und weißliche bis bräunliche Verfärbungen auf der Lithiumoberfläche ersichtlich wurden [21].
Bei geeigneten Abscheidebedingungen kann sich eine geordnete regelmäßige säulenförmige Lithiumschichtstruktur ausbilden. Die anfänglichen Keimbildungsstellen werden durch eine homogene lithiumfluoridreiche SEI-Schicht stabilisiert, wodurch die Abscheidung von metallischem Lithium stetig und gleichmäßig ablaufen kann. Durch den gleichmäßigen und kleinen Grenzflächenwiderstand sowie die niedrige Diffusionsenergiebarriere für Lithium, diffundiert Lithium schnell und wächst somit horizontal von den Keimbildungsstellen aus. Nach dem Kontakt miteinander wachsen die Lithiumkristallite dann vertikal unter der räumlichen Begrenzung und entwickeln sich zu selbstausgerichteten Säulen. Die benachbarten Säulen werden durch die SEI-Schicht, die sich auf jeder Säule bildet, am Zusammenwachsen gehindert [23]. Neben der Stromdichte ist auch die Hydrodynamik ein wichtiger Einflussfaktor für eine dendritfreie galvanische Abscheidung von metallischem Lithium. Durch eine effiziente oder gerichtete Elektrolytrührung bzw. verbessertem Stofftransport von Lithium-Ionen kann die Dominanz von einem diffusionskontrollierten hin zu einem durchtrittskontrollierten Abscheidungsprozess in einem gewissen Bereich verändert werden [24].
Im weiteren Verlauf dieses Artikels wird auf die Verwendung eines Abscheideelektrolyten bestehend aus Propylencarbonat (PC) als Lösungsmittel, Lithiumhexafluorophosphat (LiPF6) als Lithiumsalz und Wasser als „Additiv“ (zur in situ Bildung von Fluorwasserstoff zur Stabilisierung der SEI-Schicht) in eigenen Laborversuchen im Rahmen des Verbundprojektes „SolidS“ näher eingegangen.
ExperimentalteilGalvanische Lithiumabscheidung
Als Substrat wurden glatte Kupferfolien (Cu-Folien, Eppstein Foils) mit einer Schichtdicke von sd = 35 µm verwendet. Die Cu-Folien wurden mittels einer kathodischen Entfettung (Typ EL-KG, Schlötter) und Dekapieren in 5 % Schwefelsäure vorbehandelt. Die kathodische Lithium-abscheidung erfolgte in einer Glovebox unter Argonatmosphäre (99,999 % Ar, O2 < 0,5 ppm und H2O < 0,5 ppm) in einer quaderförmigen Glaszelle mit einem Volumen von ca. 300 ml. Als Abscheideelektrolyt wurde eine Mischung aus 1 M Lithiumhexafluorophosphat (LiPF6, Sigma Aldrich) gelöst in Polycarbonat (PC, Sigma Aldrich) mit eingestelltem Wassergehalt von 50 ppm verwendet.
Die zugeschnittenen Cu-Folien wurden in eine PEEK-Rahmenhalterung eingespannt, so dass nur eine definierte Substratfläche (2 cm x 2 cm) Kontakt zum Elektrolyten hatte und ein Hinterwandern der Cu-Folien durch den Elektrolyten verhindert wurde. Die Halterung war während der Lithiumabscheidung dauerhaft starr in der Glaszelle eingebaut. Die Gegenelektrode aus Lithiumfolie (Alfa Aesar, 99,9 %, Ø = 1,5 mm) wurde in einen „Anodensack“ aus verschweißtem Polypropylen (Celgard 2500, Celgard LLC) verpackt, um zu verhindern, dass mögliche Reaktionsprodukte an der Anode in den Elektrolyten bzw. bis zur Arbeitselektrode (Cu-Folie) gelangen konnten. Die Elektrolytlösungen wurden mit einem Magnetrührer mit Magnetrührstäbchen gerührt. Die Lithiumabscheidungen wurden mit einem variabel einstellbaren Galvanostat/Potentiostat (Typ MPG2 in Verbindung mit der Software EC-Lab, BioLogic) ausgeführt. Die Stromdichten j wurden im Bereich von 1–3 mA cm-2 variiert, wobei die Abscheidezeiten – gemäß dem Faraday-Gesetz – jeweils für eine nominale Lithiumschichtdicke von 11 µm berechnet bzw. angepasst wurden. Nach der galvanischen Abscheidung wurden die Schichtproben mit reinem Propylencarbonat gewaschen, um Elektrolytreste zu entfernen und in der Glovebox unter Argonatmosphäre bei Raumtemperatur (T = 28 ± 2 °C) getrocknet. Die Oberflächenmorphologie und die Schichtstruktur von galvanisch abgeschiedenen Lithiumschichten wurden mit einem hochauflösenden Rasterelektronenmikroskop (REM) (Gemini SEM 300, Zeiss) mit und ohne energiedispersiver Röntgenspektroskopie (EDX) untersucht. Für den Transfer der Lithium- Proben von der Glovebox in das REM – unter Luftausschluss – wurde ein Transfermodul (Kammrath & Weiss) verwendet.
 Abb. 1: Fotoaufnahmen von Lithiumschichten, abgeschieden auf Cu-Folie bei einer Stromdichte von a) 1 mA cm-2
Abb. 1: Fotoaufnahmen von Lithiumschichten, abgeschieden auf Cu-Folie bei einer Stromdichte von a) 1 mA cm-2
Elektrochemische Charakterisierung
Um die elektrochemischen Eigenschaften der hergestellten Lithiumschichten als metallische Lithiumanode in einer Batteriezelle bei Lade- und Entladevorgängen zu testen, wurden ausgewählte Proben von Lithiumschichten in geeigneten Testzellen im CR 2032-Knopfzellenformat untersucht. Die ausgewählten Proben (Ronden mit Ø = 14 mm) wurden in diesen Versuchen in symmetrischer Testanordnung (Lithiumelektrode gegen Lithiumelektrode) zusammengebaut und anschließend 20 Zyklen (Lade-/Entladevorgänge) lang getestet. Für diese Tests wurde ein Batterieelektrolyt bestehend aus 1 M Lithium-Bis(trifluoromethansulfonyl)imid (LiTFSI), 0,75 M Lithiumnitrat (LiNO3), gelöst in einem Gemisch aus 1,2-Dimethoxyethan (DME)/Dioxolan (DOL) (1:1), bezogen als gebrauchsfertige Lösung von E-Lyte Innovations, verwendet. Als Separator zwischen den beiden Elektroden wurde eine ausgestanzte kommerzielle Celgard 2500 Folie (Polypropylen-Membran, sd = 25 µm, Ø = 16 mm) eingesetzt.
Abscheidevariationen
Zur Optimierung der Abscheidebedingungen des Elektrolytsystems (1 M LiPF6 in PC mit 50 ppm Wassergehalt) wurden verschiedene Versuchsreihen jeweils bei Raumtemperatur (T = 28 ± 2 °C) durchgeführt. Der Wassergehalt im Abscheideelektrolyt wurde in Anlehnung an Qian et al. [21] auf 50 ppm festgelegt. Die verschiedenen Versuche wurden bei unterschiedlicher Stromdichte und Elektrolytrührung (Hydrodynamik) und mittels Gleichstrom- bzw. Pulsstromabscheidung durchgeführt.
Das Ziel der verschiedenen Versuchsreihen war die Herstellung möglichst homogener, kompakter und dendritenfreier Lithiumschichten auf Cu-Folien zur Verwendung als Lithiumanoden in Batteriezellen (z. B. für LiS-Zellen) und zusätzlich in verkürzter Beschichtungszeit. Zusätzlich wurde eine erste elektrochemische Charakterisierung der galvanisch hergestellten Lithiumanoden durchgeführt.
Variation der Stromdichte
Ein geeigneter Stromdichtebereich spielt bei der galvanischen Herstellung von Metallschichten eine wichtige Rolle, der vor allem die Art und Qualität der abgeschiedenen Schichten stark beeinflussen kann. Dies gilt für die Lithiumabscheidung aus organischen Elektrolytsystemen im besonderen Maße, da die abgeschiedenen Lithiumschichten an sich thermodynamisch sehr instabil sind. Eine zu hohe Stromdichte während der Abscheidung kann durch eine zu schnelle Abscheidung zu Oberflächendefekten führen, was Risse oder Poren in der Lithiumschicht hervorrufen kann. Zudem ist das Risiko zum Auftreten von dendritischen Mikrostrukturen auf der Oberfläche deutlich erhöht. Dabei ist der kritische Faktor das Erreichen einer stabilen und gleichmäßigen (lithiumfluoridreichen) SEI-Schicht während der gesamten Abscheidezeit [21].
In Abbildung 1 werden die Ergebnisse einer Versuchsreihe gezeigt, bei der unterschiedliche Stromdichten von 1 mA cm-2, 2 mA cm-2 und 3 mA cm-2 angewandt wurden.
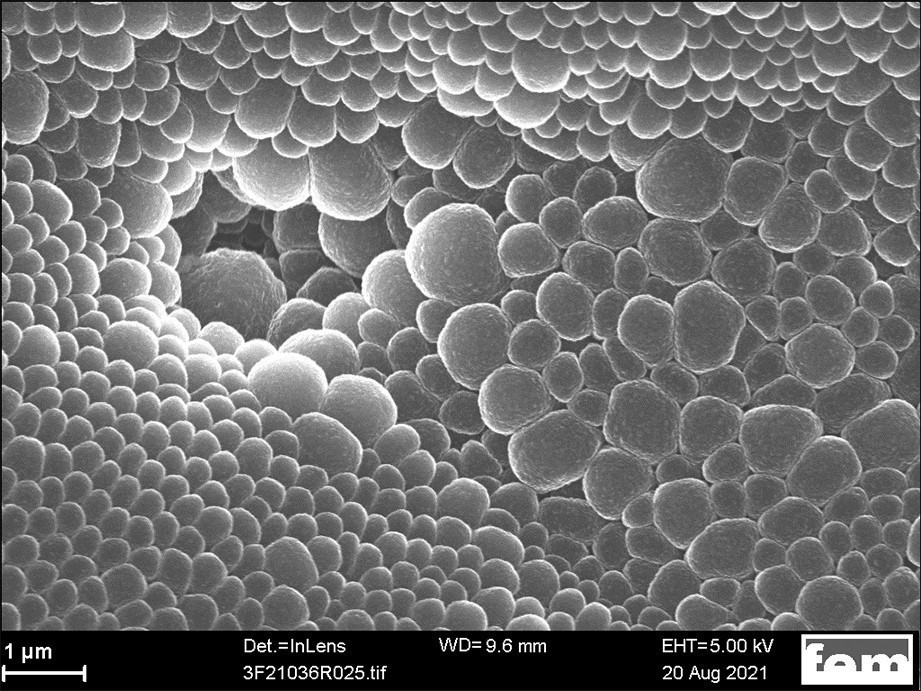
Dendritenfreie, nanostrukturierte Oberflächen von galvanisch abgeschiedenen Lithiumschichten weisen häufig eine charakteristische metallisch glänzende blau-violette Färbung auf [21]. Diese Färbung ist auf der Probe in Abbildung 1a deutlich erkennbar. Sind auf der Probe Oberflächendefekte wie z. B. Mikrorisse, Poren oder dendritische Strukturen vorhanden, geht die charakteristische Blaufärbung der Lithiumoberfläche verloren. In den REM-Aufnahmen in Abbildung 2 sind beispielhaft kleine Oberflächendefekte, wie Risse und Poren abgebildet, die in der Fläche weißliche oder fleckige Lithiumoberflächen verursachen (siehe Abb. 1b und 1c).
Mit zunehmender Stromdichte bei der Lithiumabscheidung steigt das Risiko, dass vermehrt Oberflächendefekte auf der Lithiumschicht gebildet werden. Dadurch wird aber auch deutlich, dass bei einer Erhöhung der Stromdichte – zur Verkürzung der Beschichtungszeit bzw. Herstellungszeit von Lithiumanoden – die Abscheideparameter insgesamt angepasst oder optimiert werden müssen, um eine ausreichende Schichtqualität zu gewährleisten.
Variation der Elektrolytrührung (Hydrodynamik)
Ein Teilziel im F&E-Vorhaben „SolidS“ war es, eine möglichst hohe Abscheiderate für Lithium auf Cu-Folien zu erreichen. Es ist bekannt, dass bei der galvanischen Metallabscheidung neben der Stromdichte auch die Hydro-
dynamik ein wichtiger Faktor ist, um die Metallabscheiderate zu erhöhen. In einer weiteren Versuchsreihe wurde daher der mögliche Einfluss einer Elektrolytrührung auf die Lithiumabscheidung untersucht. Der Einsatz eines Magnetrührstäbchens (3 mm x 12,5 mm) in der quaderförmigen Elektrolysezelle bewirkt eine deutliche Umwälzung des gesamten Elektrolyten und sollte dadurch die Lithiumabscheidung durch einen erhöhten Stofftransport (Verringerung der Diffusionsschichtdicke) verbessern. Durch eine zunehmende Elektrolytrührung sollten auch unerwünschte Reaktionsprodukte von der Kathode schneller entfernt werden. In der folgenden Abbildung 3 sind beispielhaft die Ergebnisse aus zwei Versuchsreihen mit drei unterschiedlichen Rührstufen (250, 500 und 750 U min-1) bei zwei vorgegebenen Stromdichten (1 und 3 mA cm-2) abgebildet.
 Abb. 3: Fotoaufnahmen von Lithiumschichten, abgeschieden auf Cu-Folie bei einer Rührstufe von a) 250 U min-1 bei einer Stromdichte von 1 mA cm-2
Abb. 3: Fotoaufnahmen von Lithiumschichten, abgeschieden auf Cu-Folie bei einer Rührstufe von a) 250 U min-1 bei einer Stromdichte von 1 mA cm-2
 Abb. 3: Fotoaufnahmen von Lithiumschichten, abgeschieden auf Cu-Folie bei einer Rührstufe von a) 250 U min-1 bei einer Stromdichte von 3 mA cm-2
Abb. 3: Fotoaufnahmen von Lithiumschichten, abgeschieden auf Cu-Folie bei einer Rührstufe von a) 250 U min-1 bei einer Stromdichte von 3 mA cm-2
Bei beiden Stromdichten treten ab einer Rührstufe von 500 U min-1 deutlich sichtbare Strömungsmuster auf (Abb. 3, Spalte b und c, jeweils untere rechte Ecke). Diese kommen durch das Umwälzen des Elektrolyten mit den Magnetrührstäbchen gegen den Uhrzeigersinn zustande. Bei einer Stromdichte von 3 mA cm-2 und einer Rührstufe 750 U min-1 ist im oberen Bereich eine weißliche Färbung und im Bereich des Strömungsmusters (untere rechte Ecke) eine metallisch glänzende bläuliche Färbung erkennbar. Zur Beurteilung des Effektes einer zunehmenden Elektrolytumwälzung (Erhöhung des Stofftransportes) auf die abgeschiedene Lithiummasse, wurde an ausgewählten Proben eine indirekte Messung der Schichtdicke vorgenommen. Hierzu wurde die Schichtdicke der Lithiumschichten im Bereich von gezielt erzeugten Bruchkanten anhand von REM-Aufnahmen unter Zuhilfenahme einer Messaufgabe der REM-Geräteeinheit ermittelt. Die Ergebnisse der Schichtdicken-bestimmung sind in der Abbildung 4 durch die schwarzen Distanzstriche dargestellt.
 Abb. 4: REM-Aufnahmen von Bruchkanten und Ergebnisse der Schichtdickenmessung an Lithiumschichten, die bei unterschiedlicher Rührstufe (a) 250 U min-1, b) 500 U min-1 und c) 750 U min-1) bei einer Stromdichte von 3 mA cm-2 abgeschieden wurden
Abb. 4: REM-Aufnahmen von Bruchkanten und Ergebnisse der Schichtdickenmessung an Lithiumschichten, die bei unterschiedlicher Rührstufe (a) 250 U min-1, b) 500 U min-1 und c) 750 U min-1) bei einer Stromdichte von 3 mA cm-2 abgeschieden wurden
Die Ergebnisse dieser indirekten Schichtdickenbestimmung zeigen, dass bei den Rührstufen 500 und 750 U min-1 der festgelegte Wert für die Sollschichtdicke von 11 µm erreicht wird. Bei der Probe, die bei der deutlich geringeren Rührstufe von 250 U min-1 abgeschieden wurde, wird dagegen nur eine Lithiumschichtdicke von etwa 7 µm anstatt von 11 µm (Sollschichtdicke) in der festgelegten Abscheidezeit erreicht (Wirkungsgrad der Lithiumabscheidung beträgt hier ca. 60 % bis 70 %). Um zu starke Rühreffekte und damit verbunden Oberflächendefekte auf und in den Lithiumschichten zu vermeiden, aber dennoch eine ausreichende Abscheiderate zu erhalten, muss die Elektrolytrührung an die Gegebenheiten des Elektrolyseaufbaus und die ausgewählte Stromdichte angepasst werden.
 Abb. 5: Fotoaufnahmen von Lithiumschichten, die mit Pulsstrom bei einer mittleren Stromdichte von 1 mA cm-2 bei verschiedenen ton/toff-Verhältnissen abgeschieden wurden a) ton= 1 s, toff = 2 s
Abb. 5: Fotoaufnahmen von Lithiumschichten, die mit Pulsstrom bei einer mittleren Stromdichte von 1 mA cm-2 bei verschiedenen ton/toff-Verhältnissen abgeschieden wurden a) ton= 1 s, toff = 2 s
 Abb. 5: Fotoaufnahmen von Lithiumschichten, die mit Pulsstrom bei einer mittleren Stromdichte von 3 mA cm-2 bei verschiedenen ton/toff-Verhältnissen abgeschieden wurden a) ton= 1 s, toff = 2 s
Abb. 5: Fotoaufnahmen von Lithiumschichten, die mit Pulsstrom bei einer mittleren Stromdichte von 3 mA cm-2 bei verschiedenen ton/toff-Verhältnissen abgeschieden wurden a) ton= 1 s, toff = 2 s
Vergleich zwischen Gleichstrom- und Pulsstromabscheidung
Bei den bisher vorgestellten Versuchsreihen zur Optimierung der Abscheideparameter wurden die Lithiumschichten mittels Gleichstromabscheidung hergestellt. Für eine mögliche Erhöhung der Stromdichte oder einer Verbesserung der Schichtqualität der herzustellenden Lithiumschichten wurden zusätzlich Abscheideversuche mittels Pulsstromabscheidung durchgeführt. Dabei besteht jede Pulsperiode aus einer Einschaltzeit (ton), bei der Strom angelegt wird, und einer Ausschaltzeit (toff), bei der kein Strom fließt. Aus diesen Parameterzusammensetzungen werden „Wellenformen“ mit Rechteckpulsen aufgebaut und wiederholt, bis die gewünschte Lithiumsollschichtdicke erreicht ist. Der Vorteil dieser galvanischen Abscheidung liegt darin, dass durch Ausschalten des Stroms die Doppelschicht und ggf. die sich ausbildende SEI-Schicht entladen werden und dadurch eine Nachlieferung von Lithium-Ionen aus dem Elektrolyten an die Elektrodenoberfläche (Kathode) verbessert wird. Somit können ggf. auch die Bereiche der Oberfläche, die stärker an Ionen verarmt sind, gleichmäßig ausgeglichen werden. Durch das Anlegen von insgesamt höheren kathodischen (Puls-) Strömen bei ton kann zusätzlich die Anzahl an Keimbildungsstellen im Vergleich zur Gleichstromabscheidung erhöht werden, wodurch letztendlich Lithiumschichten mit dünneren Lithiumsäulen in der Schichtstruktur gebildet werden [25, 26].
Für einen besseren Vergleich der Beschichtungsergebnisse mittels Gleichstrom- bzw. Pulsstromabscheidung, wurden die Versuche mit Pulsstrom ebenfalls bei einer mittleren Stromdichte von jm = 1 mA cm-2 bzw. jm = 3 mA cm-2 durchgeführt. Die ausgewählten Parameter für die Pulsstromabscheidung sind in Tabelle 1 aufgeführt. Aufgrund von früheren Erfahrungen bei der galvanischen Metallabscheidung aus organischen Elektrolytsystemen wurde in den o.g. Versuchen die Pulsdauer im Bereich von Zehntelsekunden bis wenige Sekunden gewählt. Die grundlegenden Parameter für die Pulsstromabscheidung – kathodische Pulsstromdichte jpc, Pulsfrequenz f und prozentuale Einschaltdauer Ѳ – können gemäß den Gleichungen 2–4 ermittelt werden [26]:
<Gl. 2>
<Gl. 3>
<Gl. 4>
|
Versuch |
jm |
ton |
toff |
jpc |
f |
θ |
Rührstufe |
|
PP1 |
1 |
1 |
2 |
3 |
0,33 |
33 |
500 |
|
PP2 |
0,1 |
0,2 |
3 |
3,33 |
33 |
500 |
|
|
PP3 |
0,1 |
0,3 |
4 |
2,5 |
25 |
500 |
|
|
PP4 |
3 |
1 |
2 |
9 |
0,33 |
33 |
500 |
|
PP5 |
0,1 |
0,2 |
9 |
3,33 |
33 |
500 |
|
|
PP6 |
0,1 |
0,3 |
12 |
2,5 |
25 |
500 |
In der Tabelle 1 sind die Parameter für die drei ausgewählten Verhältnisse von ton/toff für die beiden Stromdichten aufgeführt. Die kathodische Pulsstromdichte entspricht dabei der tatsächlich am Gerät angelegten Stromdichte während eines Strompulses. Die Pulsfrequenz definiert den Kehrwert der Zykluszeit aus ton und toff und beschreibt somit die Anzahl der periodischen Vorgänge aufeinanderfolgender Zyklen in einer bestimmten Zeiteinheit. Die Einschaltdauer gibt Auskunft über den prozentualen Anteil des Strompulses an der Gesamtzeit innerhalb eines Zyklus. Umso größer der Wert für θ ist, desto mehr nähert sich die Pulsstromabscheidung (θ → 100 %) einer Gleichstromabscheidung an.
In den Versuchen PP1 und PP2 (bzw. PP4 und PP5) wurde ton und toff um den Faktor 10 verändert, das Verhältnis zwischen beiden bleibt jedoch gleich. Dadurch bleibt auch der kathodische Pulsstrom und die Einschaltdauer gleich. Die Pulsfrequenz ändert sich jedoch reziprok um den Faktor 10. In dem Versuch PP3 (bzw. PP6) wird das Verhältnis ton zu toff verändert, der kathodische Pulsstrom, die Einschaltdauer und die Pulsfrequenz verändern sich dadurch im Vergleich zu den Versuchen PP1 und PP2 (bzw. PP4 und PP5). In der Abbildung 5 sind die Beschichtungsergebnisse für die in Tabelle 1 aufgeführten Kombinationen für die Abscheideversuche abgebildet.
Die Versuchsergebnisse legen nahe, dass bei den kürzeren ton/toff - Zeiten insgesamt bessere Schichtoberflächen erhalten werden. Bei den Pulsstromabscheidungen mit der höheren mittleren Stromdichte von 3 mA cm-2 ist der positive Effekt deutlich ausgeprägt. Dies ist bereits an dem Auftreten der metallisch glänzenden blau-violetten Färbung der Lithiumoberfläche visuell sichtbar. Im Gegensatz dazu wird die Schichtqualität bei den Abscheideversuchen mit einer mittleren Stromdichte von 1 mA cm-2 nicht signifikant verbessert. Auf den Lithiumoberflächen bildeten sich hier beige-weiße dendritische Strukturen. Unter diesen Abscheidebedingungen besteht eine Tendenz dazu, dass auf der anfänglich gebildeten Lithiumschicht (metallisch glänzend) eine neue Lithiumschicht mit veränderter Mikrostruktur (keine geordnete säulenartige Schichtstruktur, beige-weißlicher „Belag“) aufgebaut wird, diese aber nicht zwangsläufig aus einzelnen, unterschiedlich groß gewachsenen (nadelförmigen) dendritischen Strukturen besteht.
Insgesamt lässt sich festhalten, dass sich bei einer (mittleren) Stromdichte von 3 mA cm-2 mittels Pulsstromabscheidung Lithiumschichten mit einer besseren Schichtqualität auf Cu-Folie abscheiden lassen, im Vergleich zur Gleichstromabscheidung. Mittels Pulsstrom- und Gleichstromabscheidung hergestellte Lithiumschichten zeigen optisch teils eine ähnliche metallisch blau-violette Färbung der Oberfläche auf (siehe Abb. 6). In den REM-Aufnahmen ist dagegen eine homogenere Oberflächenmorphologie und bessere Schichtqualität bei den Proben mittels Pulsstromabscheidung erkennbar. Zudem sind insgesamt weniger Oberflächendefekte (z. B. Poren) und eine engere Verteilung der Säulendurchmesser innerhalb der abgeschiedenen Lithiumschicht vorhanden (siehe REM-Aufnahmen in Abb. 7). Zusätzlich wurde eine etwas höhere Abscheiderate für Lithium mittels Pulsstromabscheidung (~ 270 nm min-1) im Vergleich zur Gleichstromabscheidung (~ 200 nm min-1) ermittelt.
Elektrolytstabilität
Für die verschiedenen Versuchsreihen wurde jeweils ein Abscheideelektrolyt hergestellt, indem zu einer frischen Elektrolytlösung (Basiselektrolyt) gezielt Wasser zugegeben wurde bis ein formaler Wassergehalt von 50 ppm im Elektrolyten erreicht wurde. Diese Elektrolytlösung wurde gemäß Quian et al. 48 Stunden gerührt [21]. In dieser Zeit kann das zugegebene Wasser mit den PF6-Anionen des Elektrolyten reagieren und Fluorwasserstoff bilden. Dieser begünstigt während der Lithiumabscheidung die Bildung einer stabilen SEI-Schicht auf der Lithiumoberfläche. Nach einer „Wartezeit“ von 48 Stunden kann der Elektrolyt verwendet werden. Bei den Abscheideversuchen stellte sich heraus, dass für die Konditionierung des neuen Abscheideelektrolyten durchschnittlich drei bis vier Testabscheidungen notwendig sind, bis der Elektrolyt reproduzierbare Abscheideergebnisse ermöglicht. Bei den Testproben zur Elektrolytkonditionierung traten vor allem an den Rändern grobkörnige und dendritische Mikrostrukturen auf. Dies ist exemplarisch in der Abbildung 8 gezeigt.
 Abb. 8: Links: Fotoaufnahme einer Lithiumschicht mit unregelmäßigen dendritischen Mikrostrukturen, abgeschieden aus einem neuen Elektrolyten. Die rote Markierung gibt die Stelle für die REM-Aufnahme der dendritischen Mikrostrukturen an; REM-Aufnahmen mit 3.000- (Mitte) und 10.000-facher Aufnahmevergrößerung (rechts)
Abb. 8: Links: Fotoaufnahme einer Lithiumschicht mit unregelmäßigen dendritischen Mikrostrukturen, abgeschieden aus einem neuen Elektrolyten. Die rote Markierung gibt die Stelle für die REM-Aufnahme der dendritischen Mikrostrukturen an; REM-Aufnahmen mit 3.000- (Mitte) und 10.000-facher Aufnahmevergrößerung (rechts)
 Abb. 8: Links: Fotoaufnahme einer Lithiumschicht mit unregelmäßigen dendritischen Mikrostrukturen, abgeschieden aus einem neuen Elektrolyten. Die rote Markierung gibt die Stelle für die REM-Aufnahme der dendritischen Mikrostrukturen an; REM-Aufnahmen mit 3.000- (Mitte) und 10.000-facher Aufnahmevergrößerung (rechts)
Abb. 8: Links: Fotoaufnahme einer Lithiumschicht mit unregelmäßigen dendritischen Mikrostrukturen, abgeschieden aus einem neuen Elektrolyten. Die rote Markierung gibt die Stelle für die REM-Aufnahme der dendritischen Mikrostrukturen an; REM-Aufnahmen mit 3.000- (Mitte) und 10.000-facher Aufnahmevergrößerung (rechts)
 Abb. 8: Links: Fotoaufnahme einer Lithiumschicht mit unregelmäßigen dendritischen Mikrostrukturen, abgeschieden aus einem neuen Elektrolyten. Die rote Markierung gibt die Stelle für die REM-Aufnahme der dendritischen Mikrostrukturen an; REM-Aufnahmen mit 3.000- (Mitte) und 10.000-facher Aufnahmevergrößerung (rechts)
Abb. 8: Links: Fotoaufnahme einer Lithiumschicht mit unregelmäßigen dendritischen Mikrostrukturen, abgeschieden aus einem neuen Elektrolyten. Die rote Markierung gibt die Stelle für die REM-Aufnahme der dendritischen Mikrostrukturen an; REM-Aufnahmen mit 3.000- (Mitte) und 10.000-facher Aufnahmevergrößerung (rechts)
Die anschließenden Lithiumabscheidungen ergaben bei Optimierung der Abscheideparameter dendritenfreie, metallisch glänzende blau-violette Schichten. Nach mehr als vier bis fünf Abscheidungen nach der oben beschriebenen Konditionierung traten teilweise erneut dendritische Strukturen auf der Oberfläche der Lithiumproben auf. Es kann daher angenommen werden, dass nach mehreren Abscheidungen hintereinander der Gehalt an Fluorwasserstoff im Elektrolyten immer geringer wird und letztendlich keine Bildung einer stabilen (lithiumfluoridreiche) SEI-Schicht während der Lithiumabscheidung mehr ermöglicht.
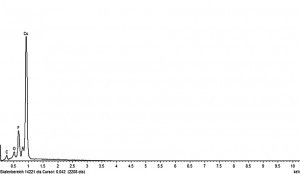
Qian et al. untersuchten in ihrer Arbeit auch den Querschnitt einer Lithiumschicht, wobei im Elementarprofil des durchgeführten EDX-Linienscans das Element Fluor sich hauptsächlich auf der Oberfläche der Lithiumschichten befand [21]. Dies legt nahe, dass sich die lithiumfluoridreiche SEI-Schicht vor allem dort aufbaut. Eigene EDX-Untersuchungen an Lithiumschichten, die aus neuen und verbrauchten Elektrolyten abgeschieden wurden, legen eine stetige Verarmung des Elektrolyten an HF im Laufe der Betriebszeit nahe. Lithiumschichten, die aus vielfach gebrauchter Elektrolytlösung abgeschieden wurden, weisen einen deutlich geringen Fluorpeak im EDX-Spektrum und eine größere Anzahl an Oberflächendefekten auf (z. B. Poren, Mikrorisse, granulare oder dendritische Strukturen auf der Oberfläche) und sind häufig zusätzlich weniger dicht. In Abbildung 9 sind exemplarisch zwei EDX-Spektren von Lithiumschichten, abgeschieden aus einer frischen und einer verbrauchten Elektrolytlösung, sowie die entsprechenden REM-Aufnahmen abgebildet.
 Abb. 9: REM-Aufnahmen und EDX-Spektren von Lithiumschichten, die aus frisch hergestelltem Elektrolyten (links) und mehrfach gebrauchten Elektrolyten (rechts) abgeschieden wurden
Abb. 9: REM-Aufnahmen und EDX-Spektren von Lithiumschichten, die aus frisch hergestelltem Elektrolyten (links) und mehrfach gebrauchten Elektrolyten (rechts) abgeschieden wurden
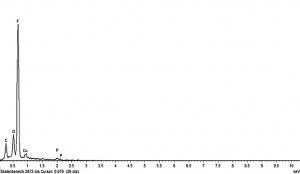 Abb. 9: REM-Aufnahmen und EDX-Spektren von Lithiumschichten, die aus frisch hergestelltem Elektrolyten (links) und mehrfach gebrauchten Elektrolyten (rechts) abgeschieden wurden
Abb. 9: REM-Aufnahmen und EDX-Spektren von Lithiumschichten, die aus frisch hergestelltem Elektrolyten (links) und mehrfach gebrauchten Elektrolyten (rechts) abgeschieden wurden
Um eine zu starke Veränderung des Elektrolyten und der SEI-Schicht zu vermeiden, wurde daher nach durchschnittlich vier bis fünf Abscheidungen die jeweilige Versuchsreihe gestoppt und der Wassergehalt des entsprechenden Elektrolyten nachjustiert und vor dem weiteren Einsatz nochmal für 48 Stunden in der Glovebox gerührt. Damit sollte gewährleistet werden, dass ausreichend Fluorwasserstoff im Elektrolyten vorhanden war, um die Ausbildung einer stabilen SEI-Schicht während der galvanischen Abscheidung zu gewährleisten. Nach ungefähr drei bis vier Nachdosierungen mit Wasser und insgesamt ca. 15 Lithiumabscheidungen wurde der entsprechende Abscheideelektrolyt jedoch meist gelb und trüb. Abbildung 10 zeigt eine verbrauchte und eine frische Elektrolytlösung (linkes Bild). Die festgestellte Elektrolytalterung ist vor allem auf eine langsame Zersetzung des organischen Lösungsmittels zurückzuführen. Bei den letzten Lithiumabscheidungen, bevor die Elektrolytlösung unbrauchbar wird, steigt somit das Risiko, dass auf der Oberfläche der Lithiumproben granulare oder dendritische Mikrostrukturen und deutlich sichtbare Färbungen auftreten (Abb. 10, rechtes Bild).
Elektrochemische Charakterisierung
Ein Teilziel des Verbundprojektes „SolidS“ ist der Einsatz von auf Cu-Folie abgeschiedenen Lithiumschichten für den Einsatz als Lithiumanode in LiS-Batteriezellen. Die galvanisch hergestellten Lithiumanoden müssen daher in der Batteriezelle elektrochemisch aktiv sein und ein Verlust an Aktivmaterial der Anode beim Laden/Entladen in der Batteriezelle (bzw. beim Auflösen/Abscheiden von Lithium der Lithiumanode) – beispielsweise durch Dendritenbildung oder Bildung einer porösen schwammigen Lithiumschicht – muss vermieden werden.
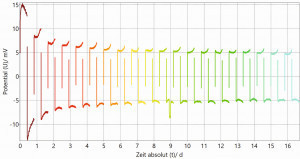
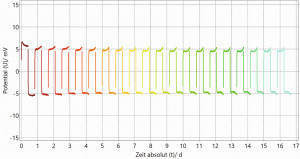
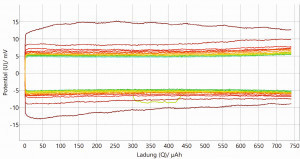
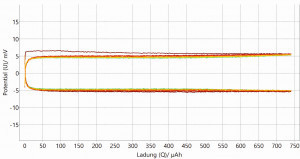
Für eine erste Bewertung der Stabilität der hergestellten Lithiumanoden wurden diese in Halbzellentests (symmetrischer Zellaufbau: Li-Elektrode gegen Li-Elektrode) zyklischen Lade-/Entladevorgängen unterzogen. In Abbildung 11 sind exemplarisch die Lade-/Entladekurve einer galvanisch hergestellten Lithiumschicht und einer kommerziellen Lithiumfolie abgebildet. In den oberen beiden Grafiken ist die Zellspannung über die Zeit (Zyklenanzahl) aufgetragen. In den beiden unteren Grafiken ist die Zellspannung über die geflossene Ladung dargestellt. Dabei ist die Zyklenanzahl (1-20) durch einen Farbverlauf von Rot nach Grün gekennzeichnet.
Die Ergebnisse der Lade-/Entladeversuche liefern bei beiden Kombinationen eine vielversprechende elektrochemische Performance. Anhand der Überspannungen der Kurven wird sichtbar, dass der 1. Zyklus von den anderen Zyklen etwas abweicht. Dies liegt an der Konditionierungsphase der gesamten Elektrodenoberfläche am Testanfang jeder neu gebauten Testzelle. Zudem ist ersichtlich, dass sich die galvanisch hergestellte Lithiumanode beim Zyklisieren deutlich stabiler verhält als die kommerzielle Lithiumfolie. Bei der galvanisch hergestellten Lithiumanode ist bereits nach dem 1. Zyklus die Überspannung stabil bei 5 mV. Bei der kommerziellen Lithiumfolie als Anode pendelt sich die Überspannung langsam von ungefähr 15 mV (1. Zyklus) auf 5 mV (ab 4.–5. Zyklus) ein. Dies kann auf die unterschiedliche Oberflächenmorphologie und Schichtstruktur der zwei verschiedenen Lithiumanoden zurückgeführt werden. Die galvanisch hergestellte Lithiumanode zeichnet sich durch eine homogene säulenförmige Schichtstruktur mit gleichmäßiger Oberflächen-morphologie aus, während die Anode aus kommerzieller Lithiumfolie eine grobkörnige und unregelmäßige Schichtstruktur und Oberflächenmorphologie aufweist.
Zusammenfassung
Die galvanische Herstellung von haftfesten, kompakten und dendritenfreien Lithiumschichten auf Kupferfolien konnte aus einem organischen Elektrolyten mit PC als Lösungsmittel, LiPF6 als Lithiumsalz und Zugabe von geringen Mengen an Wasser als Additiv erfolgreich durchgeführt werden. Zur Optimierung der Lithiumabscheidung wurden verschiedene Versuchsreihen (Variation der Stromdichte und der Elektrolytrührung, Gleichstrom- vs. Pulsstromabscheidung) durchgeführt. Vielversprechende Lithiumschichten konnten mit folgenden Abscheideparametern hergestellt werden:
Elektrolytsystem:
1 M LiPF6 in PC
Pulsstromabscheidung:
ton/toff = 0,1 s / 0,3 s, f = 2,5 Hz, θ = 25 %
Mittlere Stromdichte:
3 mA cm-2
Elektrolytrührung:
500 U min-1 (Magnetrührer)
Wassergehalt:
50 ppm
Elektrolyttemperatur:
Raumtemperatur (T = 28 ± 2 °C)
Der in der bisherigen Literatur [9, 21] angegebene Stromdichtebereich von 0,1 bis 1 mA cm-1 für die Abscheidung von dendritenfreien Lithiumschichten konnte in unseren Versuchen mit Stromdichten von 3 mA cm-2 deutlich erweitert werden.
Erste Versuche zur elektrochemischen Charakterisierung der galvanisch hergestellten Lithiumanoden (Lithiumschichtdicke: 9–12 µm) in Testzellen zeigen, dass die hergestellten Lithiumschichten im Vergleich zu kommerzieller Lithiumfolie eine sehr gute elektrochemische Stabilität während der Lade-/Entladevorgänge aufweisen. Insgesamt zeigen die verschiedenen Versuchsergebnisse aber auch, dass die Einstellung und Einhaltung eines definierten Wassergehaltes im Elektrolyten – notwendig zur Stabilisierung der SEI-Schicht während der galvanischen Abscheidung – eine praktische Herausforderung darstellt. Die vorgestellten Teilarbeiten wurden im Rahmen des Verbundprojektes „SolidS“ (Projekt-Nr. 03ETE026C) durchgeführt und vom BMWK unterstützt. Ein Dank geht auch an Dr. Kilian vom Projektträger Jülich für die Projektbegleitung.
Literatur
[1] L. Chen; L.L. Shaw: J. Power Sources, 267 (2014) 770–783
[2] G. Xu; B. Ding; J. Pan; P. Nie; L. Shen; X. Zhang: J Mater Chem A, 2 (2014) 12662–12676
[3] G.-M. Raynaud; G. Regazzoni; G. Nussbaum: Process for Obtaining Lithum-Based Thin Sheets and Its Application to the Production of Negative Plates for Accumulators, US005102475, 1992
[4] D. Eroglu; K.R. Zavadil; K.G. Gallagher: J. Electrochem. Soc., 162 (2015) A982–A990
[5] K. Kanamura; S. Shiraishi; Z. Takehara: J. Electrochem. Soc., 141 (1994) L108
[6] J.K. Stark; Y. Ding; P.A. Kohl: J. Electrochem. Soc., 160 (2013) D337–D342
[7] T. Takei: J. Appl. Electrochem., 9 (1979) 587–593
[8] J. Jorné; C.W. Tobias: J. Appl. Electrochem., 5 (1975) 279–290
[9] S. Sörgel: JEPT – J. Electrochem. Plat. Technol. (2018) Electrodeposited Dendrite-Free, Nano-Columnar 3D Lithium Anodes and Their Application in Lithium Sulfur Batteries with 3D Sulfur Cathodes, Veröffentlicht am 6. Juni 2018
[10] D. Aurbach; M.L. Daroux; P.W. Faguy; E. Yeager: J. Electrochem. Soc., 134 (1987) 1611
[11] X.-B. Cheng; R. Zhang; C.-Z. Zhao; F. Wei; J.-G. Zhang; Q. Zhang: Adv. Sci., 3 (2016) 1500213
[12] E. Santos; W. Schmickler: Angew. Chem. Int. Ed., 60 (2021) 5876–5881
[13] J.-G. Zhang; W. Xu; W.A. Henderson: Lithium Metal Anodes and Rechargeable Lithium Metal Batteries, Springer International Publishing, (2017) Cham
[14] K. Kanamura; H. Tamura; S. Shiraishi; Z. Takehara: J. Electroanal. Chem., 394 (1995) 49–62
[15] H. Ota; K. Shima; M. Ue; J. Yamaki: Electrochimica Acta, 49 (2004) 565–572
[16] K.P. Doyle; C.M. Lang; K. Kim; P.A. Kohl: J. Electrochem. Soc., 153 (2006) A1353
[17] T. Osaka; T. Momma; Y. Matsumoto; Y. Uchida: J. Electrochem. Soc., 144 (1997) 1709–1713
[18] S. Shiraishi; K. Kanamura; Z. Takehara: J. Appl. Electrochem., 25 (1995) 584–591
[19] K. Kanamura; S. Shiraishi; Z. Takehar: J. Electrochem. Soc., 143 (1996) 2187
[20] Y. Zhang; J. Qian; W. Xu; S.M. Russell; X. Chen; E. Nasybulin; P. Bhattacharya; M.H. Engelhard; D. Mei; R. Cao; F. Ding; A.V. Cresce; K. Xu; J.-G. Zhang: Nano Lett., 14 (2014) 6889–6896
[21] J. Qian; W. Xu; P. Bhattacharya; M. Engelhard; W.A. Henderson; Y. Zhang; J.-G. Zhang: Nano Energy, 15 (2015) 135–144
[22] R.M. Kasse; N.R. Geise; J.S. Ko; J. Nelson Weker; H.-G. Steinrück; M.F. Toney: J. Mater. Chem. A, 8 (2020) 16960–16972
[23] X.-Q. Zhang; X. Chen; R. Xu; X.-B. Cheng; H.-J. Peng; R. Zhang; J.-Q. Huang; Q. Zhang: Angew. Chem. Int. Ed., 56 (2017) 14207–14211
[24] X. Yang; Z. Wen; X. Zhu; S. Huang: Solid State Ion., 176 (2005) 1051–1055
[25] H. Yang; E.O. Fey; B.D. Trimm; N. Dimitrov; M.S. Whittingham: J. Power Sources, 272 (2014) 900–908
[26] M.S. Chandrasekar; M. Pushpavanam: Electrochimica Acta, 53 (2008) 3313–3322